Який об'єм газу виділився під час взаємодії міді масою 1,6 г з концетрованою нітратною кислотою масою 0,126 г?
Ответы
Відповідь:
Варто згадати деякі теоретичні відомості:
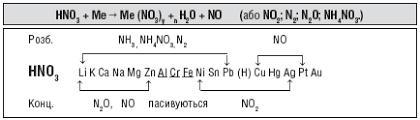
1) Нітратна кислота - сильний окисник, тому її реакції з металами значно відрізняються від реакцій металів з хлоридною та розбавленою сульфатною кислотами: при дії нітратної кислоти на метал водень ніколи не виділяється, він окиснюється з утворенням води. Взаємодія з металами супроводжується відновленням Нітрогену нітратної кислоти до різного ступеня окиснення. Продукти відновлення Нітрогену в нітратній кислоті залежать від активності металу і концентрації кислоти (див. прикріплену схему).
2) Якщо в уомвах задачі відомо маси (об'єми, або кількості) реагентів, то спочатку знаходимо який з реагентів в надлишку, а розрахунок ведемо за тією речовиною, що прореагувала повністю. Ця задача належить саме до цього класу задач.
Пояснення:
Отже, запишемо Дано
Дано:
m(Cu) = 1,6 г
m(HNO₃) = 0, 126 г
V(газу) - ?
Визначимо, яка з речовин у надлишку. Для цього спочатку обчислимо кількість речовини кожного реагенту:
моль
моль
Запишемо рівняння реакції:
0,002 моль x моль
4 HNO₃ + Cu = Cu(NO3)2 + 2 NO2 + 2 H2O
4 моль 1 моль 1 моль 2 моль 2 моль
Порівняємо відношення кількості речовини n(Cu) та n(HNO₃) до їхніх стехіометричних коефіцієнтів:
Робимо висновок, що купрум взято в надлишку, і він прореагує не повністю. Обчислення ведемо за нітратною кислотою. Позначимо кількість речовини нітроген(IV) оксиду за х. Складемо і розв'яжемо пропорцію.
x = 0,001 моль - n(NO2)
Знаючи кількість речовини нітроген(IV) оксиду, можна легко обчислити об'єм газу за формулою:
V = n * Vm (Vm - молярний об'єм = 22,4)
V(NO2) = 0,001 * 22,4 = 0,0224 л.
Відповідь: V(NO2) = 0,0224 л.