Яка маса кислоти НРО3, утвориться в результаті реакції, якщо виділилось 2500кДж теплоти? Розрахунок проведiть за термохiмiчним рівнянням реакції: 2P(т) + H2(г) + 302(г) = 2HPO3(т); ∆Н = -1965кДж/моль
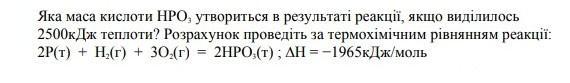
Ответы
Ответ:
Для решения данной задачи необходимо использовать закон Гесса, который утверждает, что изменение энергии реакции не зависит от пути ее протекания, а зависит только от начального и конечного состояний системы.
Сначала необходимо определить, сколько моль топлива H2 было использовано в реакции. Для этого можно использовать уравнение реакции:
2P(т) + H2(г) + 302(г) = 2hpo3(т)
Согласно уравнению, на каждые 2 моля фосфора P требуется 1 моль H2. Таким образом, если было использовано x моль P, то было использовано x/2 моль H2.
Затем можно определить, сколько энергии выделится при сгорании x моль P и x/2 моль H2. Для этого необходимо умножить количество молей на энергию образования кислоты НРО3, которая равна -1965 кДж/моль. Таким образом, энергия выделится при сгорании:
ΔH = (-1965 кДж/моль) (x моль + x/2 моль) = -2947.5 кДж
Теперь можно использовать закон Гесса, чтобы найти количество массы кислоты НРО3, которая образуется при выделении 2500 кДж теплоты. Для этого необходимо найти количество моль кислоты, которое соответствует 2500 кДж теплоты:
2500 кДж = ΔH
ΔH = (-1965 кДж/моль) n
n = 1.27 моль
Таким образом, для образования 1.27 моль кислоты НРО3 необходимо использовать x моль P и x/2 моль H2. Найдем массу кислоты НРО3, которая образуется при использовании x моль P:
m = (1.27 моль 2 молярная масса HPO3) / (x моль молярная масса P)
m = (2.54 г x) / 62.0 г/моль
Таким образом, чтобы образовалось 2.54 г кислоты НРО3, необходимо использовать:
x = (2.54 г 62.0 г/моль) / 2.54 г/моль = 62 моль P
Ответ: Для образования 2.54 г кислоты НРО3 необходимо использовать 62 моль фосфора P.