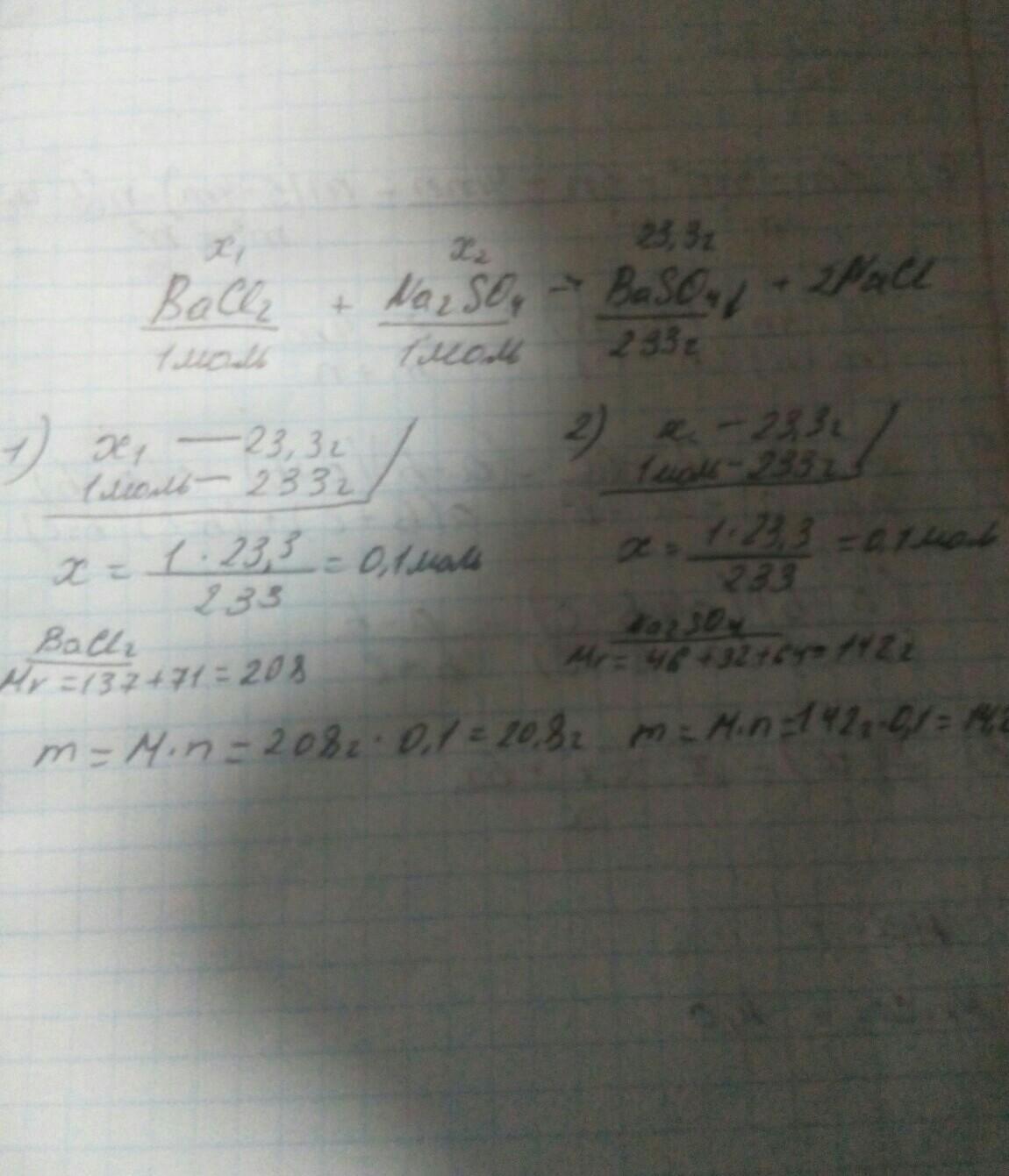получить сульфат бария реакцией обмена между хлоридом бария и сульфатом натрия. вычислите какое количество исходных веществ потребуется для получения 23,3г. сульфата бария
Ответы
Дано:
m (BaSO₄) = 23,3 г.
Найти:
m (BaCl₂)
m (Na₂SO₄)
Решение:
• Сначала запишем уравнение реакции и уравняем её:
BaCl₂ + Na₂SO₄ ===> BaSO₄↓ + 2 NaCl (реакция обмена)
• По уравнению реакции:
n (BaCl₂) : n (Na₂SO₄) : n (BaSO₄) = 1 : 1 : 1
• Найдём количество сульфата бария:
n (BaSO₄) = m/M = 23,3 г./233 г/моль = 0,1 моль
• Так как отношение количества веществ одинаковое, поэтому:
n (BaCl₂) = n (Na₂SO₄) = n (BaSO₄) = 0,1 моль
• Вычислим массу хлорида бария и сульфата натрия, необходимую для получения 23,3 грамм сульфата бария:
m (BaCl₂) = M • n = 208 г/моль • 0,1 моль = 20,8 г.
m (Na₂SO₄) = M • n = 142 г/моль • 0,1 моль = 14,2 г.
Ответ:
Для получения 23,3 грамм сульфата бария потребуется: 20,8 грамм хлорида бария (BaCl₂) и 14,2 грамма сульфата натрия (Na₂SO₄)
Объяснение:
......................................