Предмет: Химия,
автор: alekskolomickij225
Написать 6 уравнений реакций, к окислительно-восстановительным составить электронный баланса. Помогите пожалуйста! Дам 50 балов
Приложения:
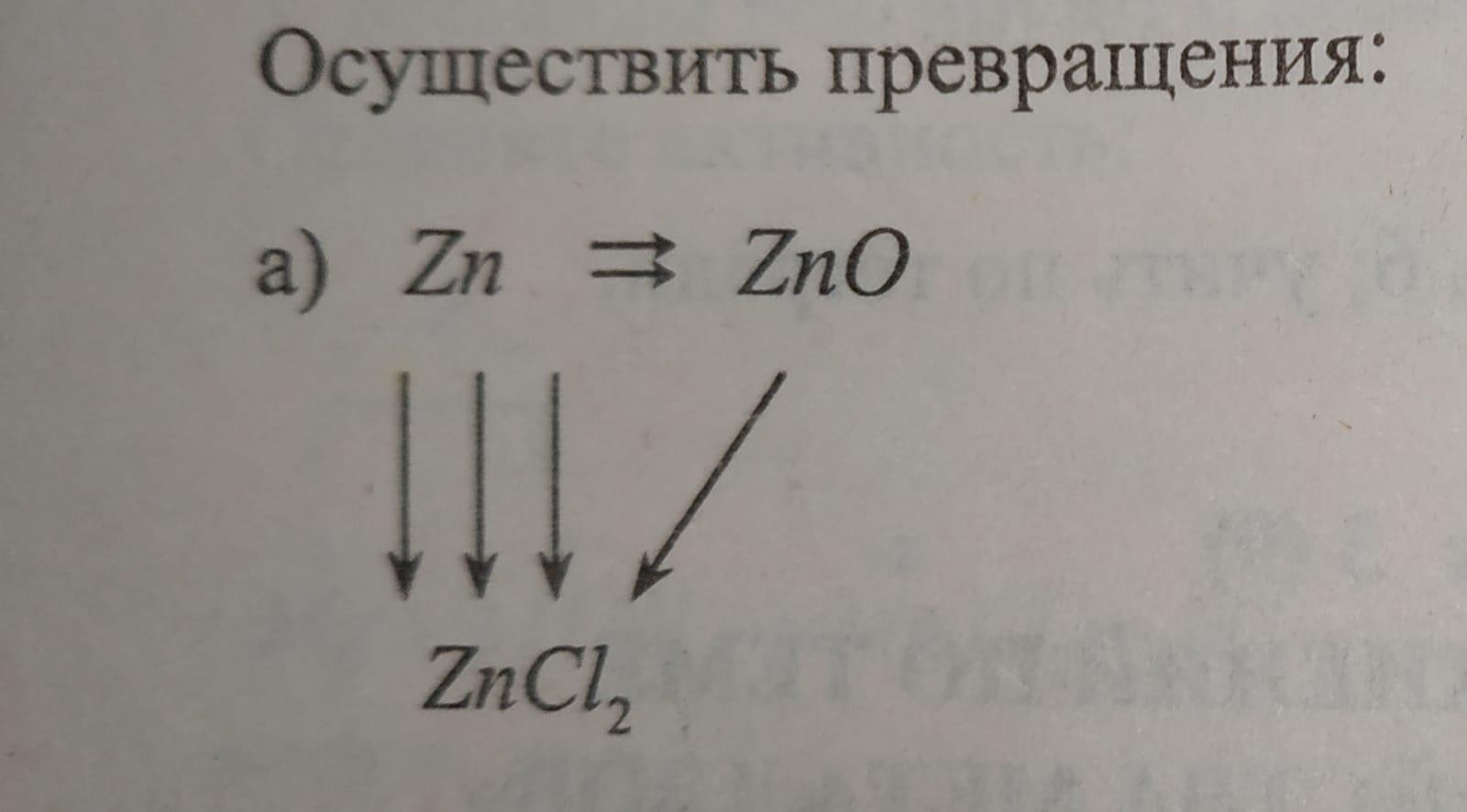
Ответы
Автор ответа:
1
Ответ:
Объяснение:
2Zn + O2 = 2ZnO
Zn(0) - 2e = Zn(+2) окисление, Zn - восстановитель ║2
О2 + 4е = 2О(-2) восстановление О2 - окислитель ║1
Zn + H2O = ZnO + H2.
Zn(0) - 2e = Zn(+2) окисление, Zn - восстановитель ║1
2Н(+) + 2е = Н2(0) восстановление 2Н(+) - окислитель║1
ZnO + 2HCl = ZnCl2 + H2O
Zn + 2HCl = ZnCl2 + H2↑
Zn + Cl2 = ZnCl2
Zn(0) - 2e = Zn(+2) окисление, Zn - восстановитель ║1
Сl2(0) + 2e = 2Cl(-) восстановление, Cl2 -окислитель ║1
Zn + CuCl2 = ZnCl2 + Zn↓
Zn(0) - 2e = Zn(+2) окисление, Zn - восстановитель ║1
Сu(+2) + 2e = Cu(0) восстановление, Сu(+2) - окислитель ║1
Похожие вопросы
Предмет: Русский язык,
автор: matveevazlata34
Предмет: Английский язык,
автор: Любознайка1
Предмет: Другие предметы,
автор: anastasiiagrum77
Предмет: Алгебра,
автор: Ксения2812