Предмет: Химия,
автор: КСеня1106
При сгорании 6,3 г органического вещества (относительная плотность по азоту составляет 3,214) выделилось 3,136 л (н.у.) углекислого газа и 1,26 мл воды. Установите молекулярную формулу исходного органического вещества, дайте ему название и составьте структурную формулу, которая однозначно отражает порядок связи атомов в его молекуле.
Ответы
Автор ответа:
0
1) Пишем реакциюCxHy + O2 = CO2 + H2OСчитаем молярную массу данного соединения M = ρ*Vm = 3.125*22.4 = 70Считаем количество вещества СО2 n = V/Vm = 28/22.4 = 1.25 моль. n(C) = 1.25 мольСчитаем количество вещества воды n = m/M = 22.5/18 = 1.25 моль. n(H) = 1.25*2 = 2.5 мольСмотрим соотношение n(C):n(H) = 1.25:2.5 = 1:2.Эмпирическая формула CH₂ и ее молекулярная масса = 14
2) Реальная молекулярная масса = 70. Поэтому 70/14 = 5. Формула вещества (CH₂)₅ ну или C₅H₁₀.
2) Реальная молекулярная масса = 70. Поэтому 70/14 = 5. Формула вещества (CH₂)₅ ну или C₅H₁₀.
КСеня1106:
Спасибо
что Вы решили? Откуда цифры?
Ксеня, за что спасибо Nick957, молярная масса изначально определена неправильно.
Это Саркози
Сарказм*
Автор ответа:
1
...............................
Приложения:
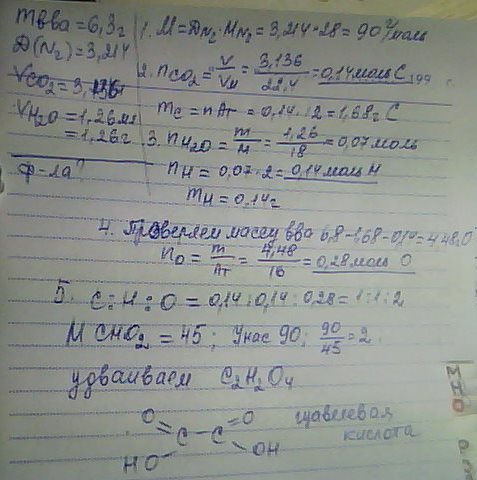
Похожие вопросы
Предмет: География,
автор: skvoniplay
Предмет: Английский язык,
автор: taisiamernenko7
Предмет: Математика,
автор: saltanatayaganova96
Предмет: Математика,
автор: Alison67
Предмет: Алгебра,
автор: leonidprokopiev