Предмет: Химия,
автор: ижжмжн
Найти степени окисления уравнения
восстановительные реакции.
Приложения:
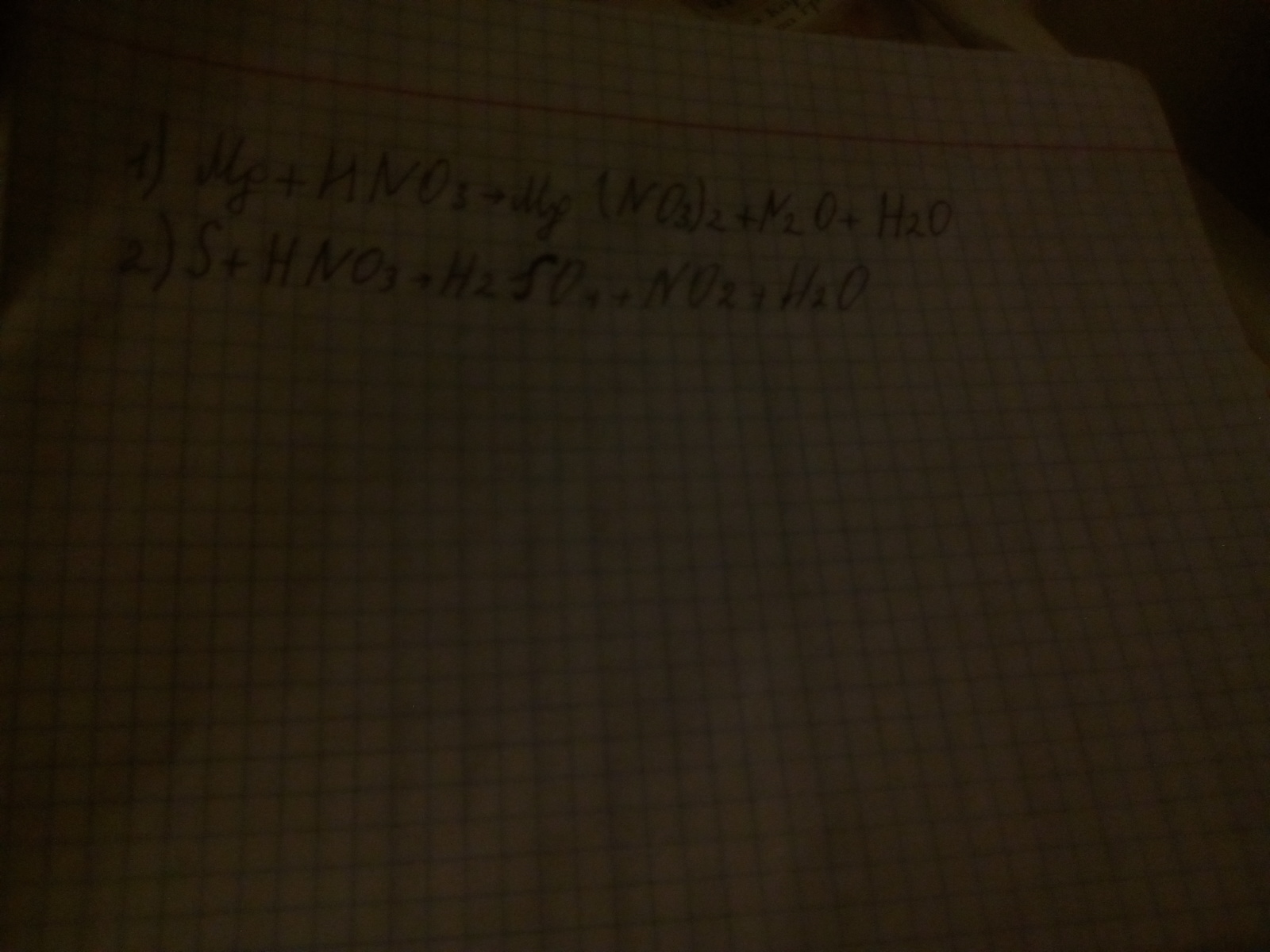
Ответы
Автор ответа:
0
1.4 Mg -2e--->Mg(+2) восстановитель
2 N(+5)+4e-->N(+1) окислитель
4 Mg + 10 HNO3 = 4 Mg(NO3)2 + 5H2O + N2O
2.S+6HNO3=H2SO4+6NO2+2H2O
S-восстановитель
N-окислитель
2 N(+5)+4e-->N(+1) окислитель
4 Mg + 10 HNO3 = 4 Mg(NO3)2 + 5H2O + N2O
2.S+6HNO3=H2SO4+6NO2+2H2O
S-восстановитель
N-окислитель
Автор ответа:
0
а можеш ише розвезать уравнение
Автор ответа:
0
это и есть ответ.1)4Mg+10HNO3=4Mg(NO3)2+5H2O+N2O.2)S+6HNO3=H2SO4+6NO2+2H2O
Похожие вопросы
Предмет: История,
автор: gabil19751
Предмет: Английский язык,
автор: skorikpolina144
Предмет: Математика,
автор: golal
Предмет: Химия,
автор: Artem62rus
Предмет: Алгебра,
автор: elvira19992