Предмет: Химия,
автор: vinfast
не могу понять как решить, помогите пожалуйста: вычислить массу серебра, которая выделиться при реакции "серебряного зеркала", если практический выход серебра 80% от теоретически возможного, если в реакцию вступило 10 грамм раствора формалина.
вместо "R" "H"
Приложения:
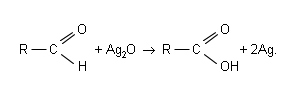
Ответы
Автор ответа:
0
n(CH2O) = 10/30 = 0,33 моль
n(Ag) = 0,33*2 = 0,66 моль - теоретическая
n(Ag) = 0,8*0,66 = 0,528 моль - практическая
m(Ag) = 0,528*108 = 57 г
n(Ag) = 0,33*2 = 0,66 моль - теоретическая
n(Ag) = 0,8*0,66 = 0,528 моль - практическая
m(Ag) = 0,528*108 = 57 г
Автор ответа:
0
HCHO+Ag2O=HCOOH+2Ag
n(HCHO)=10/30=0.33 моль
Mr(HCHO)=30
по уравнению реакции на 1 моль HCHO приходится 2 моль Ag
следовательно n(Ag)=0.33*2=0.66 моль Ar(Ag)=108
m(Ag)=108*0.66=71.28г теоретически 100% выход
находим практическую массу серебра
m(Ag)=71.2*0.8=57 г
n(HCHO)=10/30=0.33 моль
Mr(HCHO)=30
по уравнению реакции на 1 моль HCHO приходится 2 моль Ag
следовательно n(Ag)=0.33*2=0.66 моль Ar(Ag)=108
m(Ag)=108*0.66=71.28г теоретически 100% выход
находим практическую массу серебра
m(Ag)=71.2*0.8=57 г
Автор ответа:
0
m(HCHO)=10*0.4=4 г n(HCHO)=4/30=0.13 моль
Автор ответа:
0
по уравнению реакции на 1 моль HCHO приходится 2 моль Ag
следовательно n(Ag)=0.13*2=0.26 моль Ar(Ag)=108
следовательно n(Ag)=0.13*2=0.26 моль Ar(Ag)=108
Автор ответа:
0
m(Ag)=108*0.26=28.08 г теоретически 100% выход
Автор ответа:
0
аходим практическую массу серебра
m(Ag)=28.08*0.8=22.5 г
m(Ag)=28.08*0.8=22.5 г
Автор ответа:
0
эх, ворона, спасибо еще раз
Похожие вопросы
Предмет: Английский язык,
автор: sultan200515
Предмет: Геометрия,
автор: Аноним
Предмет: Информатика,
автор: cluter
Предмет: Математика,
автор: olga83g
Предмет: Алгебра,
автор: марфушенька456