Предмет: Химия,
автор: bjv04808
Помогите решить задачу
Какая масса 15% - го раствора гидроксида калия (г) потребуется для взаимодействия с раствором, содержащим 40,05 г хлорида алюминия?
Ответы
Автор ответа:
0
2KOH + AlCl3 = Al(OH)3 + 2KCl
M(AlCl3) = 133.5 г/моль
n(AlCl3)=40.05 / 133.5 = 0.3 моль
M(KOH) = 56 г/моль
n(KOH) = 2*0.3 = 0.6 моль
m(KOH) = 0.6 * 56 = 33.6 г
m( раствора KOH) = 33.6 *100/ 15 = 224 г
M(AlCl3) = 133.5 г/моль
n(AlCl3)=40.05 / 133.5 = 0.3 моль
M(KOH) = 56 г/моль
n(KOH) = 2*0.3 = 0.6 моль
m(KOH) = 0.6 * 56 = 33.6 г
m( раствора KOH) = 33.6 *100/ 15 = 224 г
Автор ответа:
0
там ответ должен получится 336
Автор ответа:
0
Пропорция была составлена неверно. А ход задачи был правильным...
Приложения:
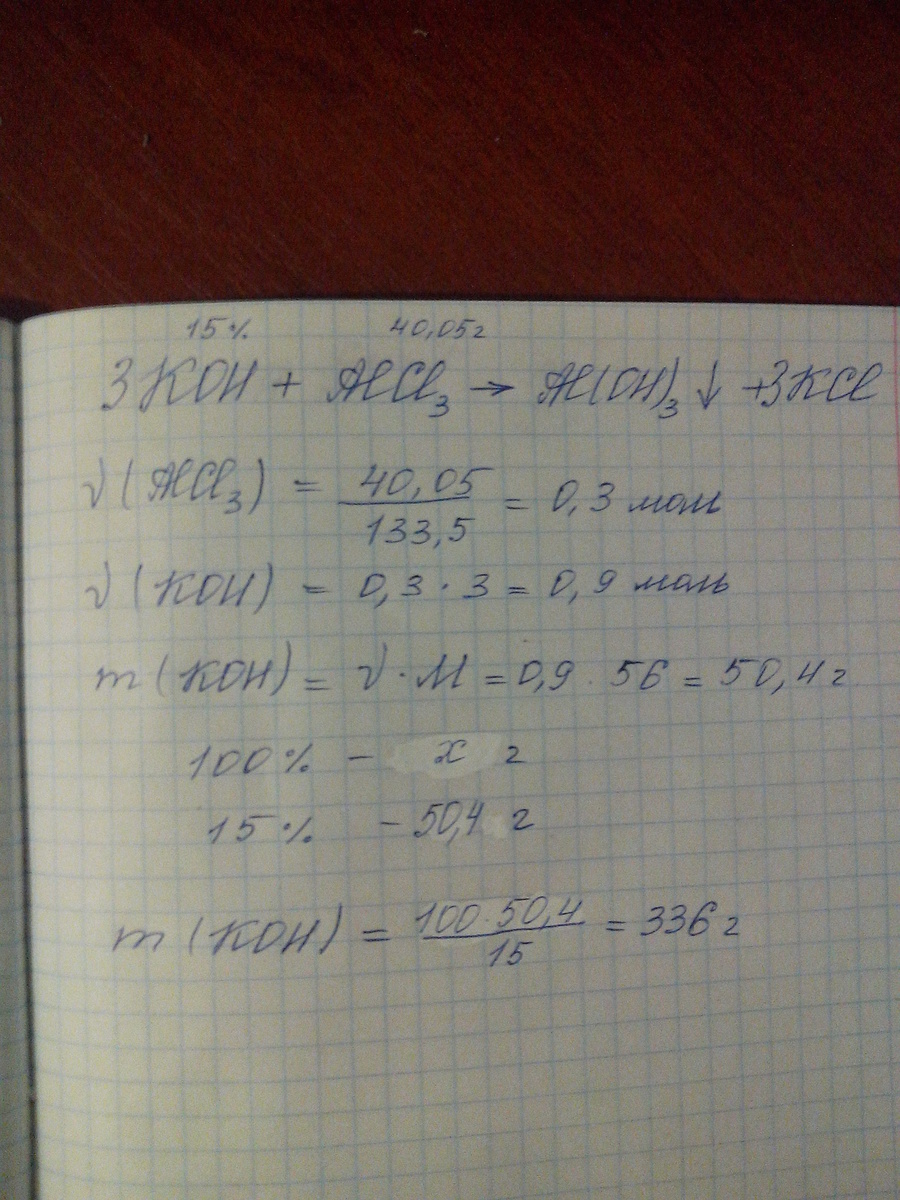
Автор ответа:
0
а откуда получилась молярная масса
Автор ответа:
0
опечаток)) w - это массовая доля
Автор ответа:
0
спасибо
Автор ответа:
0
не за что)
Похожие вопросы
Предмет: Математика,
автор: Аноним
Предмет: Алгебра,
автор: mefanov07
Предмет: Другие предметы,
автор: Zairova1973
Предмет: Алгебра,
автор: Винакур
Предмет: Биология,
автор: AnnyQween