Предмет: Химия,
автор: ТаТа114
Помогите пожалуйста, очень прошу! Образец природного известняка, масса которого 52.5г обработали избытком раствора азотной кислоты до прекращения реакции и получили 11.2л (н.у) оксида углерода(IV). Какова массовая доля примесей в известняке?
Ответы
Автор ответа:
0
хг 11,2л
CaCO3 + 2HNO3=Ca(NO3)2+H2O+CO2
100г 22,4л
х= 100*11,2/22,4=50г m (CaCO3)
ω(CaCO3) =m(CaCO3)/m известняка*100% = 50/52,5*100%=95,24%
CaCO3 + 2HNO3=Ca(NO3)2+H2O+CO2
100г 22,4л
х= 100*11,2/22,4=50г m (CaCO3)
ω(CaCO3) =m(CaCO3)/m известняка*100% = 50/52,5*100%=95,24%
Автор ответа:
0
решение в фото..............
Приложения:
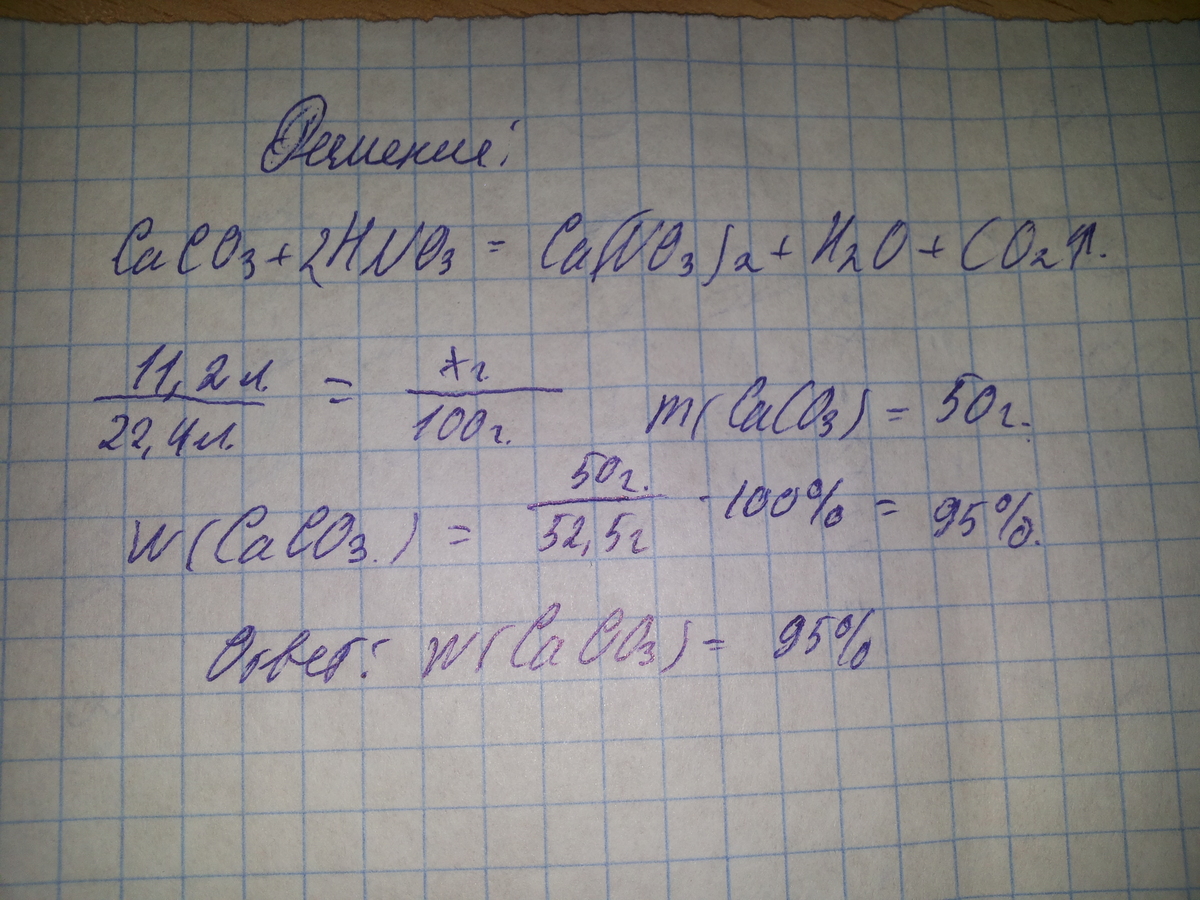
Похожие вопросы
Предмет: Информатика,
автор: uchiurokidibil111
Предмет: Информатика,
автор: uchiurokidibil111
Предмет: История,
автор: artemsahurdin569
Предмет: Физика,
автор: ыпждп