Предмет: Химия,
автор: serafimad48
Решите задачу. Рассчитайте объем аммиака, образующегося при взаимодействии 5,35 г хлорида аммония с 74 г 20%-ного раствора гидроксида кальция.
Ответы
Автор ответа:
0
Ответ:
.................. ...........
Приложения:
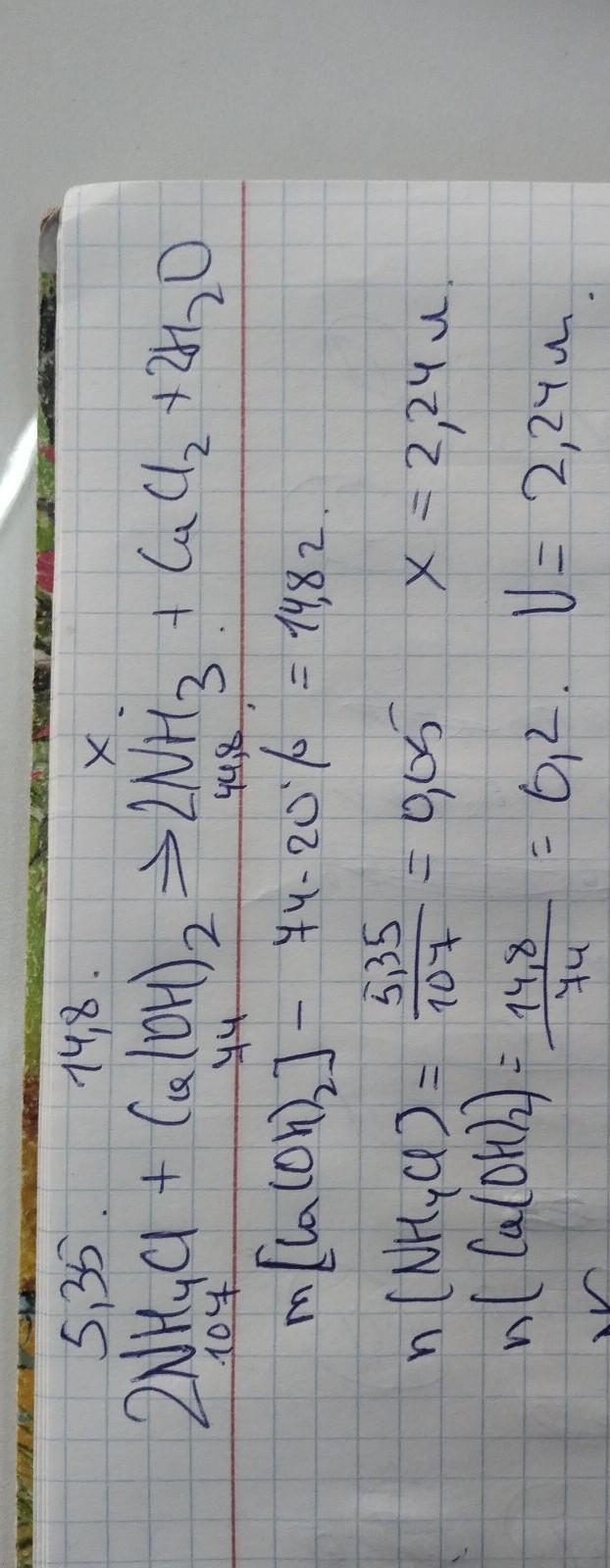
Автор ответа:
0
Ответ:
V(NH3)=1,12л/моль
Объяснение:
2NH4CL+Ca(OH)2=CaCL2+2NH3+2H2O
n(хлорид аммония) =5,35/(2×14+4×2+35,5×2)=0,05моль
74г-100%
хг-20% х=14,8г
n(гидроксид кальция )=14,8г/(40+17×2)=0,2моль
количество вещества (моль) гидроксида кальция больше то из в избытке
найдем объем аммиака через моль хлорида аммония :
n(NH4CL)=n(NH3) V=n+Vm. Vm=22,4л/моль
V(NH3)=0,05моль×22,4л/моль=1,12л
Похожие вопросы
Предмет: Информатика,
автор: aru011008
Предмет: ОБЖ,
автор: lol09999
Предмет: Українська мова,
автор: 7vmx5nfnx7
Предмет: Математика,
автор: volmary34