Предмет: Биология,
автор: emmmsuuuuu
Заповнити табличку буквами. Допоможіть
Приложения:
Ответы
Автор ответа:
0
Мільйони хімічних реакцій відбуваються всередині кожної з наших клітин щохвилини. Без каталізаторів багато з цих реакцій протікають з вкрай повільною швидкістю. Наприклад, дисоціація вугільної кислоти, яка має місце в легенях:
Н 2 СО 3 (ак) → СО 2 (г) + Н 2 О (л)
протікає тільки зі швидкістю ~10 -7 м/с при кімнатній температурі. Однак CO 2 потрібно виробляти в нашому організмі з набагато більшою швидкістю, ніж ця. Хоча теоретично можна прискорити реакцію за рахунок підвищення температури, на жаль, більшість життя сумісна лише з обмеженим температурним діапазоном.
Біологічні каталізатори, відомі як ферменти, мають вирішальне значення для життя, оскільки вони можуть прискорити реакції за рахунок факторів 10 6 -10 20. Наприклад, фермент карбоангідрази прискорює вищевказану реакцію при кімнатній температурі більш ніж в мільйон разів перевищує швидкість некаталізованої реакції.
Як і всі каталізатори, ферменти діють, поєднуючись з реагентом (ами) і тим самим утворюючи нижчі енергетичні перехідні стани. У реакції, що каталізується ферментом, реагент (и), з яким фермент поєднується, називається субстратом (ами). На відміну від хімічних каталізаторів, взаємодія ферменту з молекулами субстрату часто частково або повністю нековалентна; тобто взаємодії включають водневий зв'язок, іонні атракціони або дипольно-дипольні атракціони.
Крім того, реакції, що каталізуються ферментами, дуже специфічні для конкретного субстрату або певної категорії молекул субстрату. Кажуть, що ферменти «розпізнають» субстрат, або клас субстратів, для яких фермент служить каталізатором. Взаємодії ферментів з субстратами іноді настільки специфічні, що фермент не розпізнає молекулу, яка відрізняється від бажаного субстрату лише однією метильною (-CH 3) групою, і багато ферментів розпізнають один енантіомер, але не його дзеркальне відображення.
Як ферменти прискорюють хімічні реакції і досягають їх специфічності? Відповідь на обидва питання полягає в тому, як ферменти взаємодіють зі своїми субстратами. Зазвичай ферментом є молекула білка —макромолекула. Зазвичай тільки частина великої молекули ферменту взаємодіє з субстратом. Частина молекули ферменту, яка взаємодіє з субстратом, називається активною ділянкою.
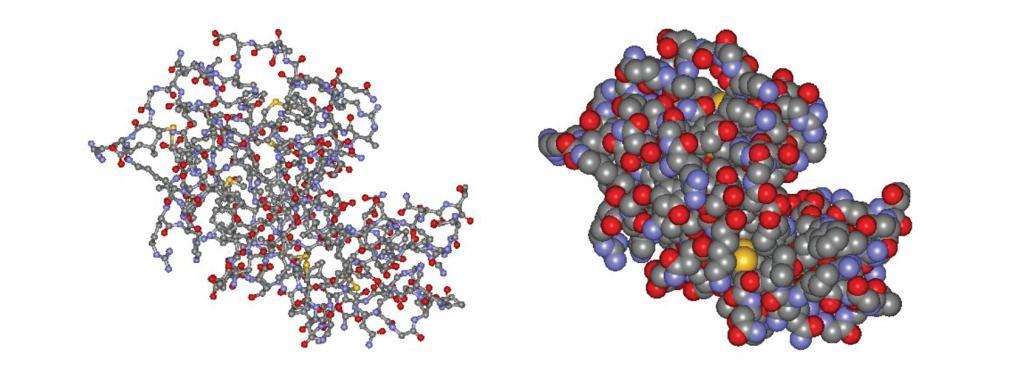
Lysozyme-BallStick-Spacefilling-1024x371.pngМалюнок 1. Структура ферменту лізоциму. Зліва: кулькова і паликова конструкція. Праворуч: структура заповнення простору. Зверніть увагу на «ущелину» посередині правого боку молекули. Молекули, реакції яких каталізуються лізоцимом, поміщаються в ущелину, яка є активною ділянкою ферменту. (Структури з http://lysozyme.co.uk. )
У 1890 році хімік Еміль Фішер запропонував, щоб субстрат вписувався в активну ділянку ферменту, оскільки ключ вписується в замок. Ключ (субстрат) має специфічну молекулярну форму (розташування функціональних груп і інших атомів), що дозволяє йому, і ніякому іншому ключу, вписатися в замок (фермент).
У 1958 році Даніель Кошланд-молодший модифікував цю модель блокування та ключа, запропонувавши, що зв'язування субстрату з ферментом змінює конфігурацію обох, забезпечуючи кращу посадку. Ця модель індукованої посадки пояснює як велике збільшення швидкості реакції, так і специфічність реакцій, що каталізуються ферментами:
У міру взаємодії субстрату з ферментом субстрат спотворюється (атоми зміщуються, зв'язки розтягуються, а реактивні групи зводяться впритул) до структури, ближче до перехідного стану реакції. Це знижує енергію перехідного стану, прискорюючи реакцію.
Тільки молекули з правильними функціональними групами в правильних конфігураціях здатні бути індуковані, щоб відповідати активній ділянці ферменту.
Протягом багатьох років вважалося, що єдиними ферментами є білки. Однак останнім часом було виявлено кілька ферментів РНК. Ці ферменти називаються рибоцимами і проявляють всі ті ж особливості, що і білкові ферменти (рис. 2).
Н 2 СО 3 (ак) → СО 2 (г) + Н 2 О (л)
протікає тільки зі швидкістю ~10 -7 м/с при кімнатній температурі. Однак CO 2 потрібно виробляти в нашому організмі з набагато більшою швидкістю, ніж ця. Хоча теоретично можна прискорити реакцію за рахунок підвищення температури, на жаль, більшість життя сумісна лише з обмеженим температурним діапазоном.
Біологічні каталізатори, відомі як ферменти, мають вирішальне значення для життя, оскільки вони можуть прискорити реакції за рахунок факторів 10 6 -10 20. Наприклад, фермент карбоангідрази прискорює вищевказану реакцію при кімнатній температурі більш ніж в мільйон разів перевищує швидкість некаталізованої реакції.
Як і всі каталізатори, ферменти діють, поєднуючись з реагентом (ами) і тим самим утворюючи нижчі енергетичні перехідні стани. У реакції, що каталізується ферментом, реагент (и), з яким фермент поєднується, називається субстратом (ами). На відміну від хімічних каталізаторів, взаємодія ферменту з молекулами субстрату часто частково або повністю нековалентна; тобто взаємодії включають водневий зв'язок, іонні атракціони або дипольно-дипольні атракціони.
Крім того, реакції, що каталізуються ферментами, дуже специфічні для конкретного субстрату або певної категорії молекул субстрату. Кажуть, що ферменти «розпізнають» субстрат, або клас субстратів, для яких фермент служить каталізатором. Взаємодії ферментів з субстратами іноді настільки специфічні, що фермент не розпізнає молекулу, яка відрізняється від бажаного субстрату лише однією метильною (-CH 3) групою, і багато ферментів розпізнають один енантіомер, але не його дзеркальне відображення.
Як ферменти прискорюють хімічні реакції і досягають їх специфічності? Відповідь на обидва питання полягає в тому, як ферменти взаємодіють зі своїми субстратами. Зазвичай ферментом є молекула білка —макромолекула. Зазвичай тільки частина великої молекули ферменту взаємодіє з субстратом. Частина молекули ферменту, яка взаємодіє з субстратом, називається активною ділянкою.
Lysozyme-BallStick-Spacefilling-1024x371.pngМалюнок 1. Структура ферменту лізоциму. Зліва: кулькова і паликова конструкція. Праворуч: структура заповнення простору. Зверніть увагу на «ущелину» посередині правого боку молекули. Молекули, реакції яких каталізуються лізоцимом, поміщаються в ущелину, яка є активною ділянкою ферменту. (Структури з http://lysozyme.co.uk. )
У 1890 році хімік Еміль Фішер запропонував, щоб субстрат вписувався в активну ділянку ферменту, оскільки ключ вписується в замок. Ключ (субстрат) має специфічну молекулярну форму (розташування функціональних груп і інших атомів), що дозволяє йому, і ніякому іншому ключу, вписатися в замок (фермент).
У 1958 році Даніель Кошланд-молодший модифікував цю модель блокування та ключа, запропонувавши, що зв'язування субстрату з ферментом змінює конфігурацію обох, забезпечуючи кращу посадку. Ця модель індукованої посадки пояснює як велике збільшення швидкості реакції, так і специфічність реакцій, що каталізуються ферментами:
У міру взаємодії субстрату з ферментом субстрат спотворюється (атоми зміщуються, зв'язки розтягуються, а реактивні групи зводяться впритул) до структури, ближче до перехідного стану реакції. Це знижує енергію перехідного стану, прискорюючи реакцію.
Тільки молекули з правильними функціональними групами в правильних конфігураціях здатні бути індуковані, щоб відповідати активній ділянці ферменту.
Протягом багатьох років вважалося, що єдиними ферментами є білки. Однак останнім часом було виявлено кілька ферментів РНК. Ці ферменти називаються рибоцимами і проявляють всі ті ж особливості, що і білкові ферменти (рис. 2).
Приложения:
Похожие вопросы
Предмет: Қазақ тiлi,
автор: timyr4570
Предмет: Другие предметы,
автор: vdovuceknorv
Предмет: Математика,
автор: cosmocheck
Предмет: Физика,
автор: ekaterinabudanova0
Предмет: История,
автор: misha44425