ДАЮ 100 БАЛЛОВ!!ОЧЕНЬ СРОЧНО ПОМОГИТЕ ПОЖАЛУЙСТА!!! ВСЕ ЗАДАНИЯ НА ФОТО
Ответы
Ответ:
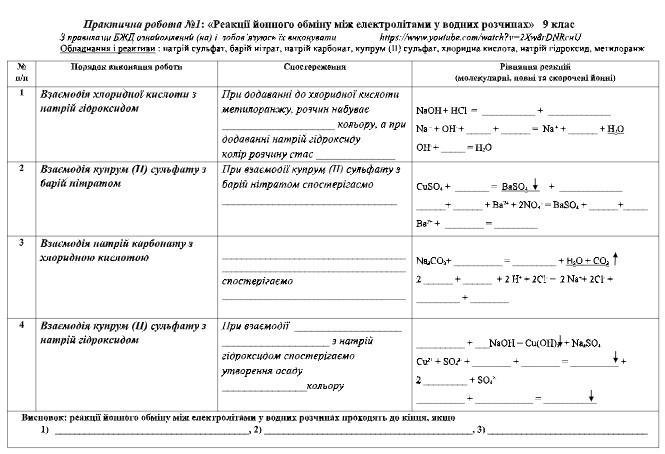
Обладнання: штатив із пробірками, піпетка.
Реактиви: хлоридна кислота НСl, розчини натрій карбонату Na2CO3, калій хлориду КСl, кальцій хлориду СаСl2, барій хлориду ВаСl2, магній хлориду MgCl2, калій броміду КВr, калій йодиду КI, калій ортофосфату К3РО4, натрій сульфату Na2SO4, натрій сульфіту Na2SO3, арґентум нітрату AgNO3, сульфатної кислоти H2SO4, натрій гідроксиду NaOH, лакмусу або метилового оранжевого.
Звіт з роботи:
Дослід 1. В першій пробірці утворюються бульбашки безбарвного газу - карбон(IV) оксиду. Рівняння реакції:
Na2CO3 + 2НСl → 2NaCl + Н2О + СО2↑
2Na+ + CO32- + 2Н+ + 2Сl- → 2Na+ + 2Сl- + Н2О + СО2↑
CO32- + 2Н+ → Н2О + СО2↑
Реакція є незворотною, оскільки серед продуктів реакції — газ і вода. Якщо замість натрій карбонату використати нерозчинну сіль магній карбонат, то реакція все одно відбуватиметься, оскільки хлоридна кислота є сильною кислотою. В другій пробірці утворюється осад білого кольору - кальцій карбонат. Рівняння реакції:
Na2CO3 + СаСl2 → 2NaCl + СаСО3↓
2Na+ + CO32- + Са2+ + 2Сl- → 2Na+ + 2Cl- + CaCO3↓
CO32- + Ca2+ + → CaCO3↓
Реакція є незворотною, оскільки серед продуктів реакції - осад. Якщо замість натрій карбонату використати нерозчинну сіль магній карбонат, то реакція відбуватися не буде, оскільки карбонат-йони CO32-не будуть вивільнятися у розчин (реакційне середовище).
Дослід 2. У першій пробірці випадатиме білий кристалічний осад - нерозчинний барій сульфат. Рівняння реакції:
ВаСl2 + K2SO4 → BaSO4↓ + 2КСl
Ва2+ + 2Сl- + 2К+ + SO42- → BaSO4↓ + 2К+ + 2Сl-
Ва2+ + SO42- → BaSO4↓
У другій пробірці випадатиме білий сирнистий осад арґентум(І) хлориду. Рівняння реакції:
ВаСl2 + 2AgNO3 → Ba(NO3)2 + 2AgCl↓
Ва2++ 2Cl- + 2Ag+ + NO3-→ Ba2+ + 2NO3- + 2AgCl↓
Cl- + Ag+ → AgCl↓
Осади різняться за зовнішнім виглядом: барій сульфат - кристалічний, арґентум (I) хлорид — сирнистий за консистенцією.
Дослід 3. В пробірці з калій хлоридом утворюється осад білого кольору. Рівняння реакції:
КСl + AgNO3 → KNO3 + AgCl↓
К+ + Сl- + Ag+ + NO3- → К+ + NO3- + AgCl↓
Cl- + Ag+ + → AgCl↓
В пробірці з калій хлоридом утворюється осад світло-жовтого кольору. Рівняння реакції:
KBr + AgNO3 → KNO3+ AgBr↓
К+ + Вr- + Ag+ + NO3- → К+ + NO3- + AgBr↓
Br- + Ag+ → AgBr↓
В пробірці з калій хлоридом утворюється осад жовтуватого кольору. Рівняння реакції:
KI + AgNO3 → KNO3 + AgI↓
К+ + I- + Ag+ + NO3- → K+ + NO3- + AgI↓
I- + Ag+ + → AgI↓
В пробірці з калій фосфатом утворюється осад яскраво-жовтого кольору. Рівняння реакції:
К3РО4 + 3AgNO3 → 3KNO3 + Ag2PO4↓
3К+ + РО43- + 3Ag+ + 3NO3- → 3К+ + 3NO3- + Ag2PO4↓
PO43- + 3Ag+ → Ag2PO4↓;
Осади в пробірках різняться за кольором.
Дослід 4. В першій пробірці лакмус змінює свій колір з червоного на фіолетовий, а метиловий оранжевий - з червоного на оранжевий. Це свідчить про зміну середовища з кислого на нейтральне. Рівняння реакції:
H2SO4 + 2NaOH → Na2SO4 + 2Н2О
2Н+ + SO42- + 2Na+ + 2ОН- → 2Na+ + SO42- + 2Н2О
H+ + OH- → H2O
За відсутності кислотно-лужного індикатора зміни в пробірці будуть непомітними. Однак реакція все одно відбуватиметься.
В другій пробірці утворюється білий осад барій сульфату. Рівняння реакції:
H2SO4 + ВаСl2 → 2НСl + BaSO4↓
2Н+ + SO42- + Ва2+ + 2Сl- → 2Н+ + 2Сl- + BaSO4↓
SO42- + Ва2+ → BaSO4↓
Лакмус та метиловий оранжевий не змінюють кольору — залишаються червоними, адже одним з продуктів реакції є хлоридна кислота. Кислотність середовища не змінюється.
В третій пробірці утворюється газоподібний сульфур(ІV) оксид. Рівняння реакції:
H2SO4 + Na2SO3 → Na2SO4 + SO2↑ + H2O
2H+ + SO42- + 2Na+ + SO32- → 2Na+ + SO42- + SO2↑ + H2O
2H+ + SO32- → SO2↑ + H2O
Лакмус змінює свій колір з червоного на фіолетовий, а метиловий оранжевий - з червоного на оранжевий. З кислого середовище стає нейтральним.
H2SO4 + MgCl2 ↔ 2НСl + MgSO4
Видимих змін в четвертій пробірці не відбувається. Реакція є оборотною і в розчині одночасно існують чотири йони: Н+, Cl-, Mg2+ та SO42-.
Висновок:
1. Реакції обміну між електролітами відбуваються до кінця у випадках, коли в результаті реакції утворюється:
газувата речовина;
осад;
вода.
2. Ознаки протікання реакцій:
в досліді 1 - утворення газу та осаду;
в досліді 2 - утворення осадів;
в досліді 3 - утворення осадів;
в досліді 4 - зміна кольору індикатору, утворення осаду, виділення газу.