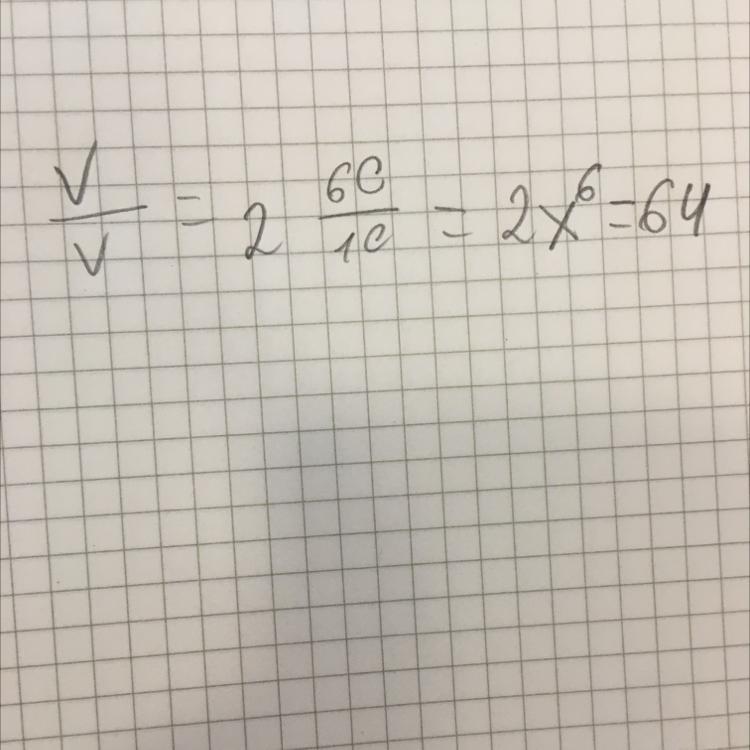Обчислити, у скільки разів зросте швидкість деякої хімічної реакції підвищенні температури на 60°С, якщо температурний коефіцієнт швидкості реакції дорівнює 2.
Ответы
Ответ:
Швидкість реакції зросте в 2 рази при підвищенні температури на 60 °C, якщо температурний коефіцієнт швидкості реакції дорівнює 2.
Объяснение:
Для обчислення, у скільки разів зросте швидкість хімічної реакції при підвищенні температури, можна використовувати рівняння Арреєвої (рівняння швидкості хімічної реакції):
k2 = k1 * e^(Ea / (R * T2)) / e^(Ea / (R * T1))
Де:
k2 - нова швидкість реакції при температурі T2
k1 - початкова швидкість реакції при температурі T1
Ea - активаційна енергія
R - універсальна газова стала (приблизно 8.314 Дж/(моль·К))
T2 - нова температура (в Кельвінах)
T1 - початкова температура (в Кельвінах)
У нашому випадку, ми маємо температурний коефіцієнт швидкості реакції (k2/k1) = 2 (зростання у два рази) і підвищення температури на 60 °C.
Тепер перетворимо температури в Кельвіни:
T1 = (60 + 273) K = 333 K
T2 = (60 + 60 + 273) K = 393 K
Знаючи значення T1, T2 та k2/k1, ми можемо знайти Ea (активаційну енергію) з рівняння:
2 = e^(Ea / (8.314 J/(molK) * 333 K)) / e^(Ea / (8.314 J/(molK) * 393 K))
Тепер спростимо це рівняння:
2 = e^(Ea / (2778.642 J/mol)) / e^(Ea / (3093.402 J/mol))
Тепер поділимо ліву частину на праву:
2 = e^(Ea / (2778.642 J/mol - 3093.402 J/mol))
2 = e^(-314.76 J/mol)
Тепер, щоб визначити Ea, візьмемо натуральний логарифм обох сторін:
ln(2) = ln(e^(-314.76 J/mol))
ln(2) = -314.76 J/mol
Ea = -ln(2) / (314.76 J/mol)
Ea ≈ .693 / 314.76
Ea ≈ 0.0022 кДж/моль
Отже, активаційна енергія реакції дорівнює приблизно 0.0022 кДж/моль.