Предмет: Химия,
автор: kerimovorhan301
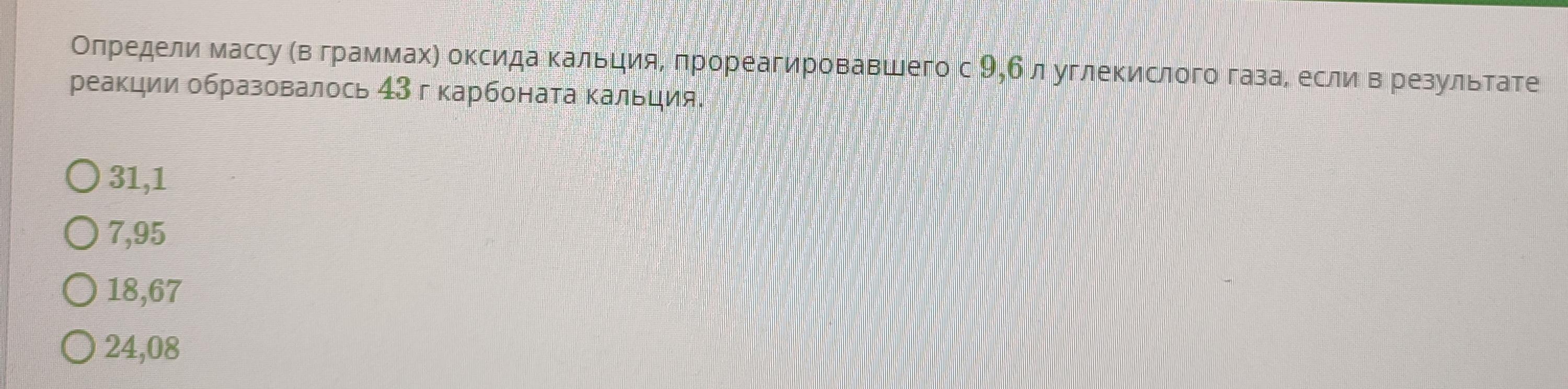
Определи массу (в граммах) оксида кальция, прореагировавшего с 9,6 л углекислого газа, если в результате реакции образовалось 43 г карбоната кальция.
Приложения:
Ответы
Автор ответа:
0
Ответ:
1. Объем CO2 = 9,6 л
2. Масса CaCO3 = 43 г
3. Масса одного моля CaCO3 = 100,09 г/моль
Количество молей CO2 = Объем CO2 / Объем одного моля CO2 = 9,6 л / 22,4 л/моль ≈ 0,4286 моль
Масса CO2 = Количество молей CO2 * Масса одного моля CO2 = 0,4286 моль * 44,01 г/моль ≈ 18,86 г
Масса CaO (оксида кальция) = 18,86 г
Объяснение:
kerimovorhan301:
получается, 18,67?)
Да
Похожие вопросы
Предмет: Русский язык,
автор: the2021
Предмет: Английский язык,
автор: mashakonchich
Предмет: Математика,
автор: davidsss236155
Предмет: Қазақ тiлi,
автор: Аноним
Предмет: Математика,
автор: genamihailov287