Предмет: Физика,
автор: gecdenis11
3. У балоні об’ємом 10 л міститься повітря за тиску 1200 кПа. Яким стане тиск газу, якщо відкрити кран, що з’єднує цей балон з іншим, об’ємом 80 літрів, із якого викачане повітря? Т=const.
4. Газ знаходиться у гумовій кулі. При збільшенні тиску в 1.5 разу об'єм газу зменшився на 45 мл. Знайти початковий об'єм. Процес ізотермічний.
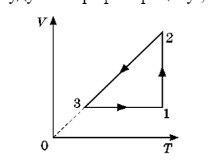
5. Побудувати графік процесу , що відбувається з ідеальним газом у координатах (р,Т):
Приложения:
Ответы
Автор ответа:
1
3. Для розв'язання цієї задачі використаємо закон Бойля-Маріотта, який описує відношення між об'ємом і тиском ідеального газу при сталій температурі:
P1 * V1 = P2 * V2
Де:
P1 = початковий тиск (1200 кПа)
V1 = початковий об'єм (10 л)
P2 = новий тиск (невідомий)
V2 = новий об'єм (10 л + 80 л = 90 л)
Підставимо відомі значення і розв'яжемо для P2:
1200 кПа * 10 л = P2 * 90 л
P2 = (1200 кПа * 10 л) / 90 л = 133.33 кПа
Отже, після відкриття крану тиск газу становить приблизно 133.33 кПа.
4. За законом Бойля-Маріотта для ізотермічного процесу ми маємо:
P1 * V1 = P2 * V2
Де:
P1 - початковий тиск
V1 - початковий об'єм
P2 - новий тиск (збільшений в 1.5 разу)
V2 - новий об'єм (зменшений на 45 мл, що відповідає 0.045 л)
Ми шукаємо початковий об'єм V1, тому:
V1 = (P2 * V2) / P1
Підставимо відомі значення:
V1 = ((1.5 * P1) * (V1 - 0.045 л)) / P1
Тепер вирішимо це рівняння для V1:
V1 = (1.5 * (V1 - 0.045 л))
Розкриємо дужки:
V1 = 1.5 * V1 - 0.0675 л
Тепер виділимо V1:
0.5 * V1 = 0.0675 л
V1 = (0.0675 л) / 0.5
V1 = 0.135 л
Отже, початковий об'єм газу становить 0.135 л.
5. Для побудови графіку процесу ідеального газу у координатах (P, T) потрібно знати залежність між тиском і температурою під час цього процесу. Без цієї залежності неможливо побудувати точний графік.
Зазвичай для ідеального газу графік в координатах (P, T) є прямолінійним, але його характер може змінюватися залежно від умов процесу (наприклад, чи є температура стала під час процесу). Тому, для побудови точного графіку, вам потрібно знати функціональну залежність між P і T у вашому конкретному випадку.
P1 * V1 = P2 * V2
Де:
P1 = початковий тиск (1200 кПа)
V1 = початковий об'єм (10 л)
P2 = новий тиск (невідомий)
V2 = новий об'єм (10 л + 80 л = 90 л)
Підставимо відомі значення і розв'яжемо для P2:
1200 кПа * 10 л = P2 * 90 л
P2 = (1200 кПа * 10 л) / 90 л = 133.33 кПа
Отже, після відкриття крану тиск газу становить приблизно 133.33 кПа.
4. За законом Бойля-Маріотта для ізотермічного процесу ми маємо:
P1 * V1 = P2 * V2
Де:
P1 - початковий тиск
V1 - початковий об'єм
P2 - новий тиск (збільшений в 1.5 разу)
V2 - новий об'єм (зменшений на 45 мл, що відповідає 0.045 л)
Ми шукаємо початковий об'єм V1, тому:
V1 = (P2 * V2) / P1
Підставимо відомі значення:
V1 = ((1.5 * P1) * (V1 - 0.045 л)) / P1
Тепер вирішимо це рівняння для V1:
V1 = (1.5 * (V1 - 0.045 л))
Розкриємо дужки:
V1 = 1.5 * V1 - 0.0675 л
Тепер виділимо V1:
0.5 * V1 = 0.0675 л
V1 = (0.0675 л) / 0.5
V1 = 0.135 л
Отже, початковий об'єм газу становить 0.135 л.
5. Для побудови графіку процесу ідеального газу у координатах (P, T) потрібно знати залежність між тиском і температурою під час цього процесу. Без цієї залежності неможливо побудувати точний графік.
Зазвичай для ідеального газу графік в координатах (P, T) є прямолінійним, але його характер може змінюватися залежно від умов процесу (наприклад, чи є температура стала під час процесу). Тому, для побудови точного графіку, вам потрібно знати функціональну залежність між P і T у вашому конкретному випадку.
Похожие вопросы
Предмет: Математика,
автор: lerochkalav40
Предмет: История,
автор: nikitakluyev364
Предмет: Биология,
автор: lulu59755
Предмет: Литература,
автор: tatevbaloyan