помогите решить задачу39. Хлорид натрия массой 5,85 г обработали при комнат-ной температуре раствором серной кислоты с w (H,50) = = 98 % массой 20 г. Выделившийся газ пропустили через избыток раствора AgNO . Определите массу полученного осадка, если выход продукта в первой реакции равен 80 %, а во второй - 90 %. Какая масса раствора серной кислоты затрачена?
Ответы
Удачи!!!!!!!!!!!!!!!!!!!!!!!!

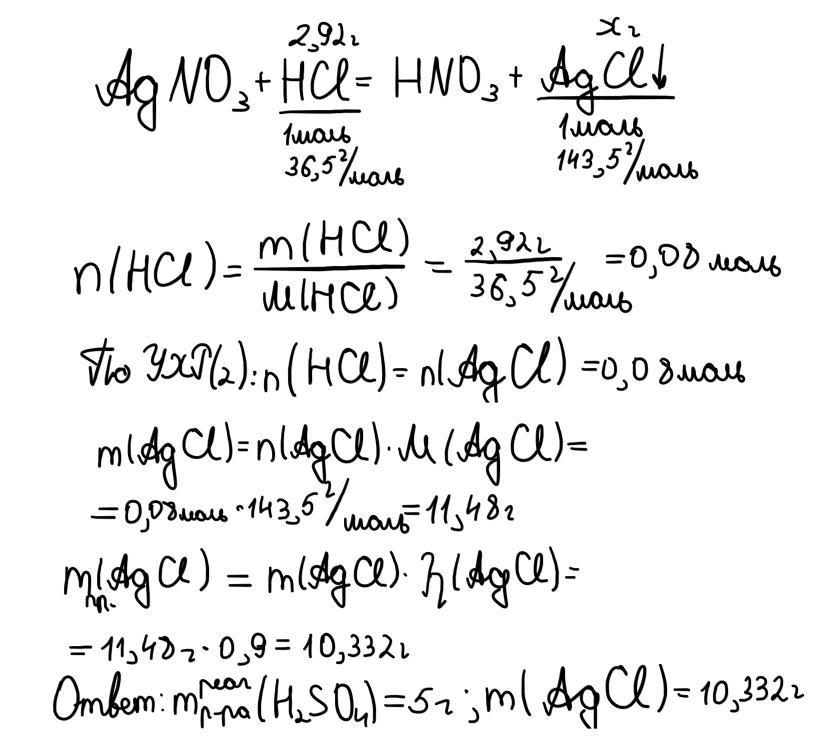
Дано:
m(NaCl) = 5,85 г
ω(H2SO4) = 98%
m р-ра(H2SO4) = 20 г
η1 = 80%
η2 = 90%
Найти:
m практ.(осадка) - ?
m р-ра реаг.(H2SO4) = 20 г
Решение:
1) NaCl + H2SO4 (конц.) -(комн. t°C)→ NaHSO4 + HCl↑;
HCl + AgNO3 → AgCl↓ + HNO3;
2) n(NaCl) = m / M = 5,85 / 58,5 = 0,1 моль;
3) m(H2SO4) = ω * m р-ра / 100% = 98% * 20 / 100% = 19,6 г;
4) n(H2SO4) = m / M = 19,6 / 98 = 0,2 моль;
5) NaCl в недостатке, расчеты по нему;
6) n теор.(HCl) = n(NaCl) = 0,1 моль;
7) n практ.(HCl) = η1 * n теор. / 100% = 80% * 0,1 / 100% = 0,08 моль;
8) n теор.(AgCl) = n практ.(HCl) = 0,08 моль;
9) n практ.(AgCl) = η2 * n теор. / 100% = 90% * 0,08 / 100% = 0,072 моль;
10) m практ.(AgCl) = n практ. * M = 0,072 * 143,5 = 10,332 г;
11) n реаг.(H2SO4) = n(NaCl) = 0,1 моль;
12) m реаг.(H2SO4) = n реаг. * M = 0,1 * 98 = 9,8 г;
13) m р-ра реаг.(H2SO4) = m реаг. * 100% / ω = 9,8 * 100% / 98% = 10 г.
Ответ: Масса практическая AgCl составляет 10,332 г; затраченного раствора H2SO4 - 10 г.