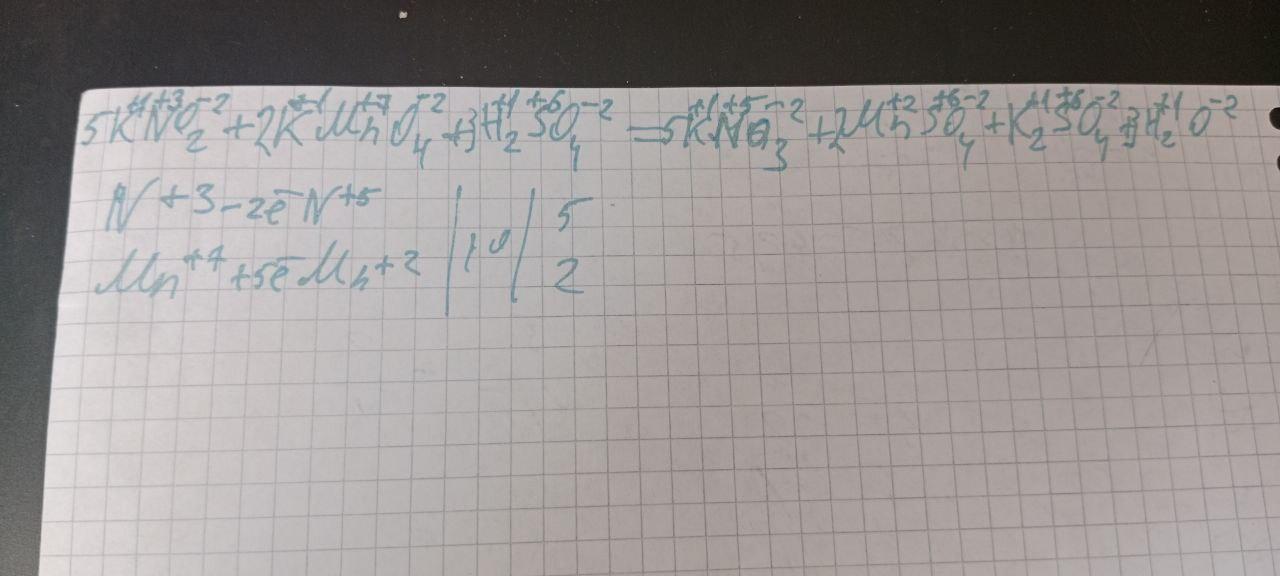32. KNO2 + KMnO4 + H2SO4 →
→ KNO3 + MnSO4 + K2SO4 + H20
(g), если
Найдите массу окислителя
в данной окислительно-
восстановительной реакции вступает
в реакцию 0,5 mol восстановителя.
A) 9,8 B) 31,6
D) 47,4
C) 15,8
Ответы
Ответ:
31,6 г.
Объяснение:
ОВР в прикреплённом файле. Из уравнения видим, что KNO₂ является восстановителем, а KMnO₄ - окислителем.
По условию задачи кол-во восстановителя равно 0,5, а по уравнению реакции - 5. Кол-во вещества окислителя по условию задачи мы не знаем, но видим, что по уравнению реакции оно равно 2. Число 2 меньше числа 5 в 2,5 раза (5/2=2,5). Следовательно, окислителя будет в 2,5 раза меньше:
ν KMnO₄ = 0,5/2,5 = 0,2
Используя таблицу Менделеева, найдём молярную массу массу вещества. Для этого сложим атомные массы калия, марганца и кислорода, не забывая, что у кислорода индекс 4.
M KMnO₄ = 39+55+16*4=158 г/моль
Зная кол-во вещества и молярную массу, легко найдём массу, используя формулу: ν = m/M
m = ν*M
m KMnO₄ = 0,2 моль * 158 г/моль = 31,6 г.
Ответ: 31,6 г.