При нагріванні 10 г суміші гідроксидів міді та натрію виділилося 0,1 моль води. Визначте масові частки гідроксидів у суміші.
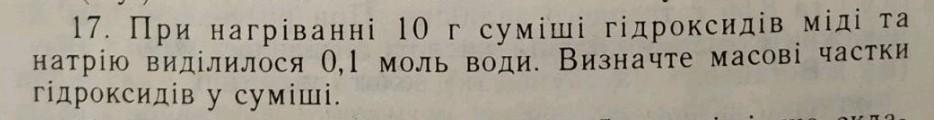
Ответы
Спочатку визначимо, який гідроксид міді та натрію утворив воду при нагріванні. Оскільки масові співвідношення міді та натрію у суміші не відомі, то можна припустити, що реакція протікала за наступною схемою:
Cu(OH)2 + 2NaOH → Na2[Cu(OH)4]
Тому маса води, яка утворилась, дорівнює:
n(H2O) = 0,1 моль
m(H2O) = n(H2O) * M(H2O) = 0,1 моль * 18 г/моль = 1,8 г
Далі можна визначити масу гідроксиду міді та натрію у суміші:
m(Cu(OH)2) = m(H2O) * (1 моль / 2 моль) * (97 г/моль / 18 г/моль) = 5,39 г
m(NaOH) = m(H2O) * (2 моль / 1 моль) * (40 г/моль / 18 г/моль) = 8,89 г
Тому масові частки речовин у суміші будуть:
%Cu(OH)2 = m(Cu(OH)2) / (m(Cu(OH)2) + m(NaOH)) * 100% = 5,39 г / (5,39 г + 8,89 г) * 100% = 37,77%
%NaOH = m(NaOH) / (m(Cu(OH)2) + m(NaOH)) * 100% = 8,89 г / (5,39 г + 8,89 г) * 100% = 62,23%