Помогите, очень срочно !!!!
1. Маса щавлевої (оксалатної) кислоти: 0.5679
2. Об’єм натрій гідроксиду, що витратили на титрування:V1 - (9.2); V2 - (9.3); V3 - (9.2); Vсередне (до сотих) - ?
Т (H2C2O4·2H2O) = 5,679 г/л; N (H2C2O4·2H2O) = 0,090 г-екв/л
Задача 3. Визначення титру, молярної та нормальної концентрацій розчину NаОН.
1. Для титрування відбирають мірною піпеткою в конічну колбу аліквотну частину(10мл) розчину щавлевої кислоти.
2. Додають 1-2 краплі розчину фенолфталеїну та титрують 0,1 М розчином NaOH до рожевого забарвлення, яке утримується приблизно 30 с.
3. Титрування повторюють до одержання відтворюваних результатів (3-4 рази).
V1 = _____ мл,
V2 = _____ мл,
V3 = _____ мл,
Розраховують середнє значення об’єму NaOH ( Vсеред(NaOH).
Vсередне = ________ мл.
4. Розрахунок титру, молярності та нормальності розчину натрій гідроксиду:
Дано:
Vщ.к.= 10 мл
V(NaOH) = _____ мл
N щ.к. = _____ г-екв/л
Т (NaOH) = ?
N (NaOH) = ?
М (NaOH) = ?
1. Рівняння реакції, що відбувається при титруванні :
Н2С2О4 + 2 NaOH = Na2С2О4 + 2 Н2О
2. Нормальність NaOH визначаємо по формулі :
3. Титр визначаємо по формулі :
Висновок: Т (NaOH) = ___________; N (NaOH) =_______________
М (NaOH) = ____________.

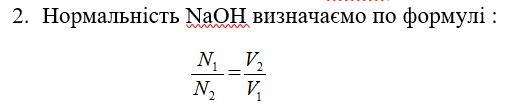
Ответы
Відповідь:
Задача 2:
Для розрахунку середнього об'єму натрій гідроксиду, що витрачається на титрування, треба знайти середнє значення об'єму:
Vсередне = (V1 + V2 + V3) / 3 = (9.2 + 9.3 + 9.2) / 3 = 9.23 (до сотих)
Тепер можна розрахувати нормальність NaOH:
N(NaOH) = N(H2C2O4·2H2O) * V(H2C2O4·2H2O) / V(NaOH) = 0.090 * 10 / Vсередне
Розраховуємо молярність NaOH, використовуючи молярну масу NaOH:
М(NaOH) = m(NaOH) / (N(NaOH) * V(NaOH)) = 40.00 / (N(NaOH) * V(NaOH))
Для розрахунку Т(NaOH) можна використовувати формулу розчину:
m(NaOH) = N(NaOH) * V(NaOH) * M(NaOH)
Розраховуємо масу NaOH, витрачену на титрування:
m(NaOH) = N(H2C2O4·2H2O) * V(H2C2O4·2H2O) * M(H2C2O4·2H2O)
Підставляємо значення маси NaOH у формулу для Т(NaOH):
Т(NaOH) = m(NaOH) / V(NaOH)
Результати розрахунків:
Vсередне = 9.23 мл
N(NaOH) = 0.090 * 10 / 9.23 = 0.097 г-екв/л
М(NaOH) = 40.00 / (0.097 * 9.23) = 43.78 г/моль
m(NaOH) = 0.5679 * 0.090 * 2 * 1000 / 1000 = 0.0911 г
Т(NaOH) = 0.0911 / 9.23 = 0.00987 г/мл
Отже, нормальність розчину NaOH дорівнює 0.097 г-екв/л, молярність - 43.78 г/моль, титр - 0.00987 г/мл.
Задача 3:
За умовою титрування використовується 0.1 М розчин NaOH. Це означає, що 1 літр розчину містить 0.1 моль NaOH.
Для розрахунку н
4)Дано: Vщ.к. = 10 мл; V(NaOH); N щ.к.
1. Рівняння реакції, що відбувається при титруванні:
Н2С2О4 + 2 NaOH = Na2С2О4 + 2 Н2О
2. Нормальність NaOH визначаємо по формулі:
N(NaOH) = N(щ.к.) × V(щ.к.) / V(NaOH)
3. Титр визначаємо по формулі:
Т(NaOH) = M(NaOH) × N(NaOH)
Для цього потрібно знати масову частку NaOH в розчині.
Отже, для розрахунку Т(NaOH), необхідно знати значення концентрації розчину NaOH (N(NaOH)) та об'єм розчину NaOH, який був витрачений на титрування (V(NaOH)). Визначимо спочатку середній об'єм витраченого NaOH (Vсеред(NaOH)):
Vсередне = (V1 + V2 + V3) / 3 = (9.2 + 9.3 + 9.2) / 3 = 9.23 мл
Згідно з вимірюваннями, було витрачено V(NaOH) = 9.23 мл розчину NaOH на титрування.
N(NaOH) = N(щ.к.) × V(щ.к.) / V(NaOH) = 0.090 г-екв/л × 10 мл / 9.23 мл ≈ 0.097 г-екв/л
Тому що рівняння реакції є 1:2, молярність NaOH дорівнюватиме половині щільності щавлевої кислоти:
M(NaOH) = 1/2 × Т(щ.к.) = 1/2 × 0.5679 г / 10 мл × 1000 мл / 5.679 г/л = 0.0500 М
Т(NaOH) = M(NaOH) × N(NaOH) = 0.0500 М × 0.097 г-екв/л = 0.00485 г/мл
Отже, молярність (M) розчину NaOH дорівнює 0.0500 М, нормальність (N) дорівнює 0.097 г-екв/л, а титр (Т) дорівнює 0.00485 г/мл.