Предмет: Химия,
автор: IvanPetrov12
Сколько килограммов 68-процентной азотной кислоты можно получить из 276 кг(н.у.) оксида азота (IV)?
Ответы
Автор ответа:
0
Дано:
V (NO2)=134.4 м3
w (HNO3)=68%
Найти:
m(HNO3)-?
Решение
4NO2+O2+2H2O=4HNO3
V (NO2)=134.4 м3
w (HNO3)=68%
Найти:
m(HNO3)-?
Решение
4NO2+O2+2H2O=4HNO3
Приложения:
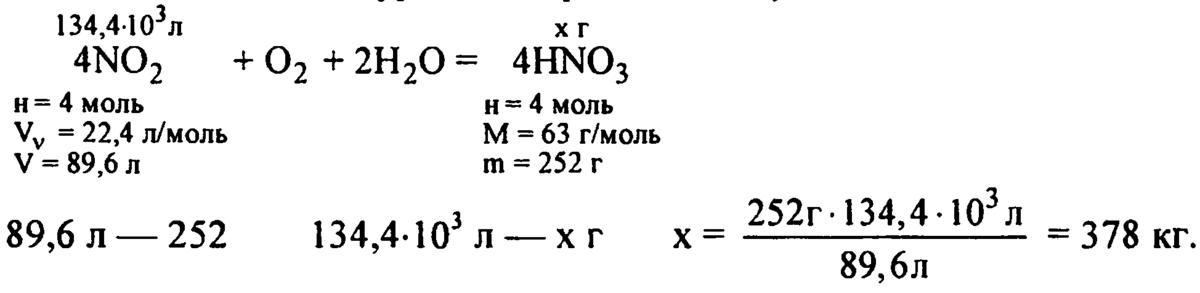
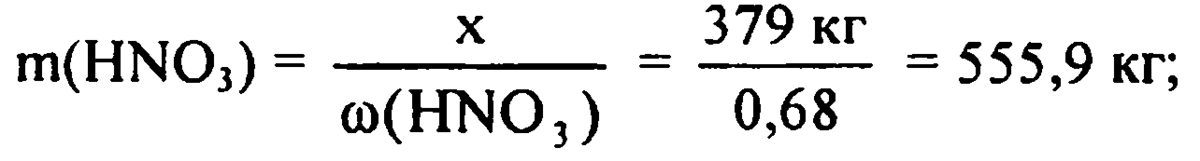
Автор ответа:
0
дана масса, а не объём!
Автор ответа:
0
Ок,сейчас перерешаю
Автор ответа:
0
Mr(NO2)=14+2*16=46 г/моль
Mr(HNO3) = 1+14+3*16=63 г/моль
составим пропорцию:
46 г/моль ------> 63 г/моль
276 кг --------> х кг(276*63)/46=378 кг чистой азотной кислоты
Т.к. выход продукта 68% составим пропорцию:
378 кг HNO3 ------------- 100%
y ------------ 68%
y= (378*68)/100=257.04 кг HNO3
Mr(HNO3) = 1+14+3*16=63 г/моль
составим пропорцию:
46 г/моль ------> 63 г/моль
276 кг --------> х кг(276*63)/46=378 кг чистой азотной кислоты
Т.к. выход продукта 68% составим пропорцию:
378 кг HNO3 ------------- 100%
y ------------ 68%
y= (378*68)/100=257.04 кг HNO3
Автор ответа:
0
спасибо!
Похожие вопросы
Предмет: Физика,
автор: YuYang455
Предмет: Математика,
автор: 1234512356
Предмет: Русский язык,
автор: ale5678
Предмет: Химия,
автор: msemenov1998
Предмет: Биология,
автор: aneskina