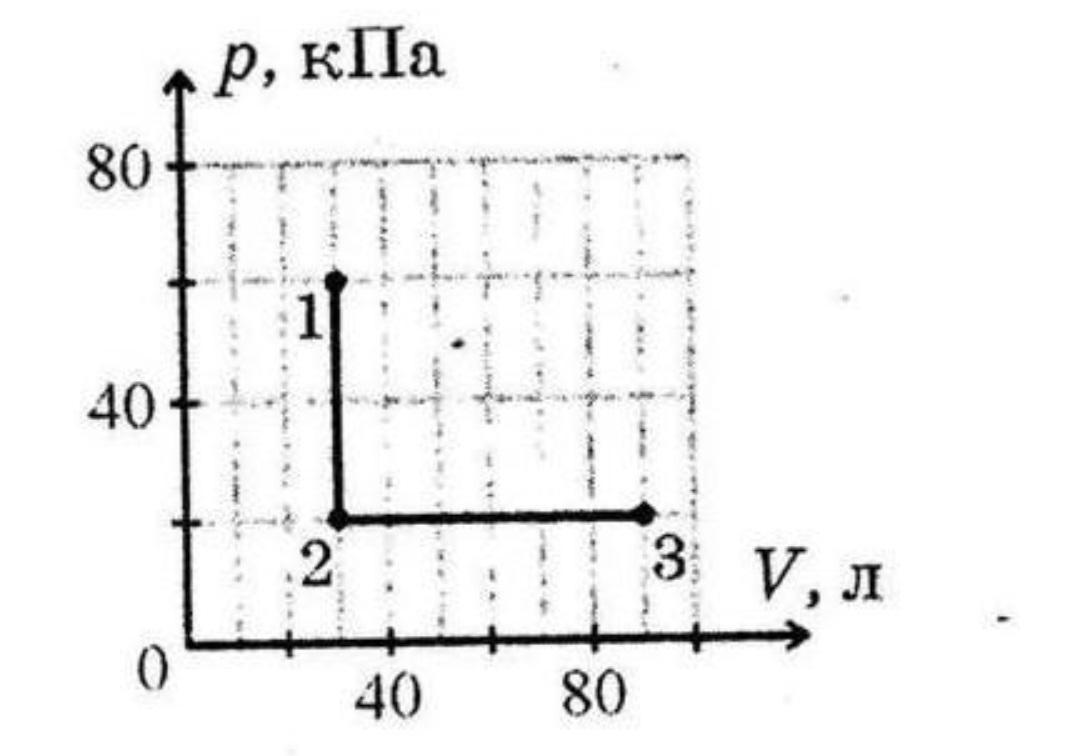
Яку кількість теплоти отримав або віддав одноатомний ідеальний газ на кожному з етапів процесу, який показано на рисунку? Потрібно рішення.
Ответы
Запишемо дані для двох ділянок, згідно графіку:
1-2: p₁ = 60 кПа = 60 * 10³ Па, p₂ = 20 кПа = 20 * 10³ Па
V₁ = V₂ = 30л = 30 * 10⁻³ м³
2-3: p₁ = p₂ = 20 кПа = 20 * 10³ Па
V₁ = 30л = 30 * 10⁻³ м³, V₂ = 90л = 90 * 10⁻³ м³
При вирішуванні задачі основною формулою буде 1 закон термодинаміки:
Q = ΔU + A, де Q - кількість теплоти, яку отримала або віддала система, що йде на зміну її внутрішньої енергії ΔU та виконанням ситеми роботи A.
Розглянемо ділянку 1-2:
- за сталого об'єму V = const тиск газу зменшується.
- пригадаємо, що за ізохорного процесу газ не виконує роботи, оскільки V = const.
- 1 закон термодинаміки набуває вигляду:
Q = ΔU
Внутрішню енергію ідеального одноатомного газу обчислюють за формулою:
ΔU = 3/2vRΔT, де ΔU - зміна внутрішньої енергії, v - кількість речовини, R - універсальна газова стала (=8.31 Дж/моль * К), ΔT - зміна температури.
За рівняння Менделєєва-Клапейрона:
pV = vRΔT, тому формула для внутрішньої енергії набуває вигляду:
ΔU = 3/2pΔV
ΔU = 3/2 * (p₂V - p₁V)
ΔU = 3/2 * 30 * 10⁻³ * 10³(20 - 60)
ΔU = 3/2 * 30 * (-40)
-ΔU = 1800 Дж
Отже:
Q = -1800 Дж (газ віддав 1800 Дж)
Розглянемо ділянку 2-3:
- за сталого тиску р = const збільшується об'єм газу
- для ізобарного процесу роботу обчислюємо за формулою:
A = pΔV, тому і 1 закон термодинаміки має той самий вигляд:
Q = 3/2pΔV + pΔV = pΔV(3/2 + 1) = 2.5pΔV
Q = 2.5 * 20 * 10³ * 10⁻³(90 - 30) = 2.5 * 20 * 60 = 3000 Дж - газ отримав 3000 Дж теплоти
Відповідь: 1-2: Q = -1800 Дж (газ віддав 1800 Дж теплоти)
2-3: Q = 3000 Дж (газ отримав 3000 Дж теплоти)