ПОМОГИТЕ В ХИМИЕЙ ПЛИЗ ДАЮ 90 БАЛОВ
Ответы
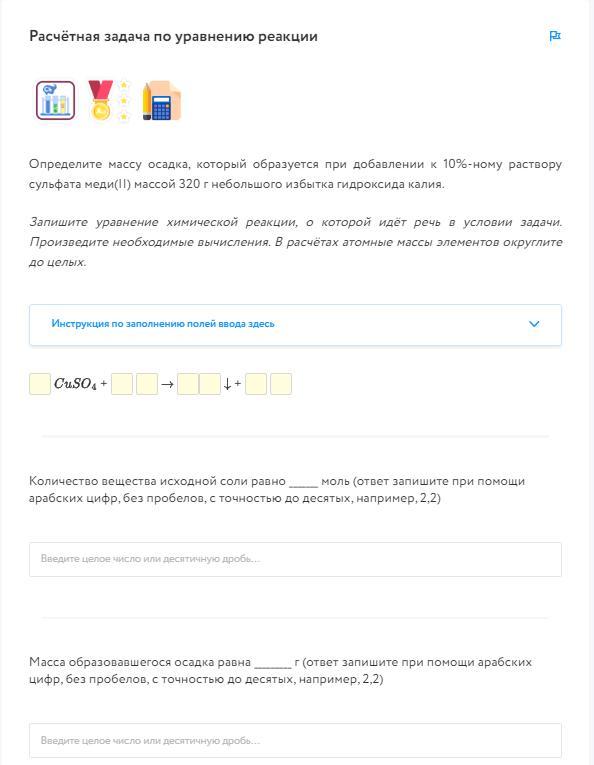
Уравнение реакции между сульфатом меди(II) и гидроксидом калия:
CuSO4 + 2KOH → Cu(OH)2↓ + K2SO4
Молярная масса CuSO4 = 64 + 32 + (4 × 16) = 160 г/моль
Молярная масса KOH = 39 + 16 + 1 = 56 г/моль
Массовая доля CuSO4 в 10%-ном растворе равна 10 г на 100 мл или 100 г на литр, то есть концентрация равна 100 г/л.
Молярная концентрация CuSO4 равна:
C(CuSO4) = 100 г/л ÷ 160 г/моль = 0.625 моль/л
Масса KOH, необходимого для полного осаждения меди:
n(KOH) = n(CuSO4) ÷ 2 = (0.625 моль/л) ÷ 2 = 0.3125 моль/л
m(KOH) = n(KOH) × M(KOH) = 0.3125 моль/л × 56 г/моль = 17.5 г
Масса осадка Cu(OH)2:
m(Cu(OH)2) = m(CuSO4) - m(KOH) = 320 г - 17.5 г = 302.5 г
Ответ: масса осадка Cu(OH)2, который образуется при добавлении к 10%-ному раствору сульфата меди(II) небольшого избытка гидроксида калия, равна 302.5 г.