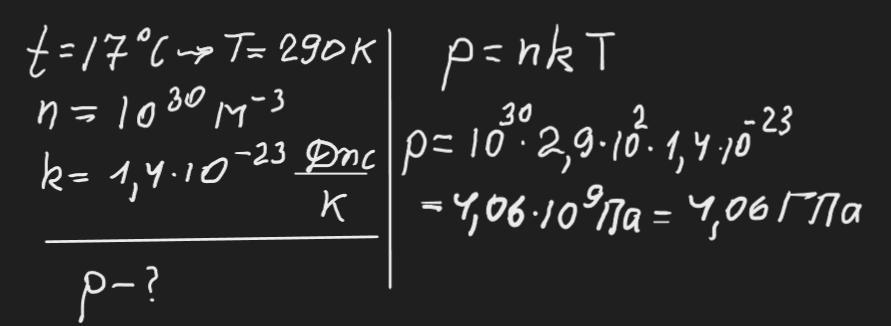Визначити тиск ідеального газу при температурі 17 С і
концентрації 10^30 м^-3 . Стала Больцмана 1,4⸱10^-23 Дж/К.
З нормальним розв'язком! Будь ласка
Ответы
Ответ:Для того, щоб визначити тиск ідеального газу при заданій температурі і концентрації, можна використати ідеальну газову закономірність, яка виглядає так:
PV = nRT
Де:
P - тиск газу, Па
V - об'єм газу, м3
n - кількість молекул газу, моль
R - стала Больцмана, Дж/моль*К
T - температура, К
Отже, щоб визначити тиск газу, треба відомі температуру і кількість молекул газу, а також сталу Больцмана. Об'єм газу можна обчислити, якщо відомий об'єм рідини, в якій розташований газ, і концентрація молекул газу. За допомогою закону Оскара-Лауба, об'єм газу можна обчислити так:
V = N / c
Де:
V - об'єм газу, м3
N - кількість молекул газу, моль
c - концентрація молекул газу, моль/м3Припустимо, що температура ідеального газу рівна 17°С, що в цільсій системі вимірювання дорівнює 17 + 273 = 290 К. Кількість молекул газу дорівнює 10^30 моль, а стала Больцмана рівна 1,4⸱10^-23 Дж/К. Об'єм рідини, в якій розташований газ, дорівнює 1 м3. За допомогою закону Оскара-Лауба обчислимо концентрацію молекул газу:
c = N / V = 10^30 моль / 1 м3 = 10^30 моль/м3
За допомогою ідеальної газової закономірності обчислимо тиск ідеального газу:
P = nRT / V = 10^30 моль * 1,4⸱10^-23 Дж/К * 290 К / 1 м3 = 4,06⸱10^5 Па
Объяснение:
Відповідь: 4,06 ГПа
Пояснення: