Лугом із масовою часткою натрій гідроксиду 30% нейтралізували 1,5 моль α-амінопропіонової кислоти. Визначте масу використаного розчину лугу.
Ответы
Ответ:
Для реакции с 1,5 моль α-аминопропионовой кислоты использовано 200 г 30%-ного раствора гидроксида натрия.
Объяснение:
Щелочью с массовой долей гидроксида натрия 30% нейтрализовали 1,5 моль α-аминопропионовой кислоты.
Определить массу использованного раствора щелочи.
Для справки:
Аминокислоты - это органические вещества, имеющие в своем составе две функциональные группы: аминогруппу и карбоксильную (кислотную) группу.
Проявляют амфотерные свойства: за счет аминогруппы - основные свойства, за счет карбоксильной группы - кислотные свойства.
α-аминопропионовая кислота - это аминокислота, которая входит в состав белков живых организмов, имеет название аланин.
Взаимодействует с основаниями по карбоксильной функциональной группе.
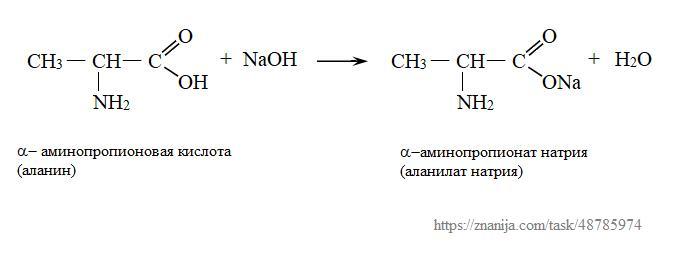
1) Запишем уравнение реакции взаимодействия α-аминопропионовой кислоты с гидроксидом натрия:
CH₃-CH(NH₂)-COOH + NaOH → CH₃-CH(NH₂)-COONa + H₂O
2) Найдем количество вещества гидроксида натрия, вступившего в реакция с 1,5 моль аланина.
По уравнению реакции:
n (аланина) : n(NaOH) = 1 : 1.
Тогда, с 1,5 моль аланина прореагируют 1,5 моль NaOH.
3) Найдем массу 1,5 моль NaOH.
M(NaOH) = 23 + 16+ + 1 = 40 г/моль
m(NaOH) = n · M = 1,5 моль · 40 г/моль = 60 г.
Для реакции с 1,5 моль аланина требуется 60 г гидроксида натрия.
3) Найдем массу 30%-ного раствора гидроксида натрия из пропорции.
60 г - 30%
m (р-ра) г - 100%
(г).
Для реакции с 1,5 моль α-аминопропионовой кислоты использовано 200 г 30%-ного раствора гидроксида натрия.