вот такое. химиииииииииииииииимия
Ответы
Ответ:
Объяснение:
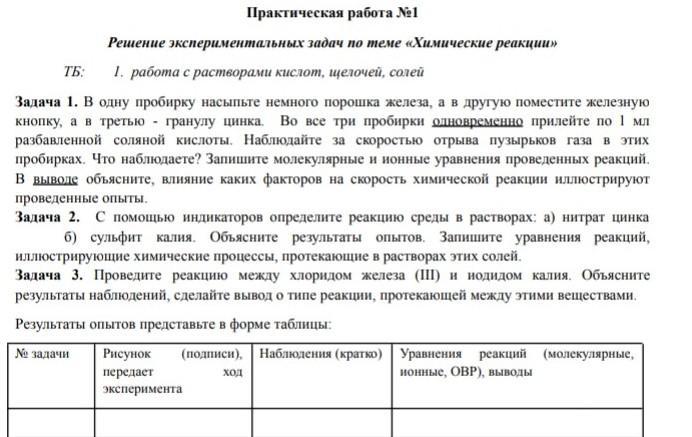
№1 Колба 1: Fe(порошкообразный) + 2HCl = FeCl2 + H2 ( Среднее количество пузырьков)
Fe + 2H+ + 2Cl- = Fe2+ + 2Cl- + H2
Fe + 2H+ = Fe2+ + H2
Колба 2: Fe(кнопка) + 2HCl = FeCl2 + H2 ( Низкое количество пузырьков)
Fe + 2H+ + 2Cl- = Fe2+ + 2Cl- + H2
Fe + 2H+ = Fe2+ + H2
Колба 3: Zn + 2HCl = ZnCl2 + H2 ( Тут больше всего пузырьков )
Zn + 2H+ + 2Cl- = Zn2+ + 2Cl- + H2
Zn + 2H+ = Zn2+ + H2
Количество выделяющихся пузырьков газа зависит от S соприкосновения Fe и HCl ( когда порошок ==> больше контакт в-ва с кислотой, а когда кнопка, то меньше ,т.к. реагирует только поверхностный слой Fe)
Также ,если сравнить кол-во пузырьков с Fe и Zn , то будет больше у Zn , т.к. данный металл по электрохимическому ряду напряжений стоит левее Fe.
№2
Zn(NO3)2:
1 ступень гидролиза:
Zn(NO3)2 + HOH ⇄ ZnOHNO3 + HNO3
Zn2+ + HOH ⇄ ZnOH+ + H+
2 ступень гидролиза:
ZnOHNO3 + HOH ⇄ Zn(OH)2 + HNO3
ZnOH+ + HOH ⇄ Zn(OH)2 + H+
Среда кислая (pH < 7 ) , т.к. выделяется H+
K2SO3:
1 ступень гидролиза:
K2SO3 + HOH ⇄ KHSO3 + KOH
SO32- + HOH ⇄ HSO3- + OH-
2 ступень гидролиза:
KHSO3 + HOH ⇄ H2SO3 + KOH
HSO3- + HOH ⇄ H2SO3 + OH-
Среда щелочная (pH > 7 ) , т.к. выделяется OH-
№3
2FeCl3 + 6KI = 2FeI2 + I2 + 6KCl - Окислительно-восстановительная реакция ,т.к. происходит изменение степеней окисления элементов)
или возможна такая реакция:
2FeCl3 + 2KI ⇄ 2FeCl2 + I2 + 2KCl ( на холоду и реакция обратимая)
Признак реакции: Выпадение серых кристаллов , которые сразу возгоняются. (Т.е. из твердных кристаллов сразу выделяется фиолетовый газ)