срочно помогите пожалуйста
Уравняй методом электронного баланса
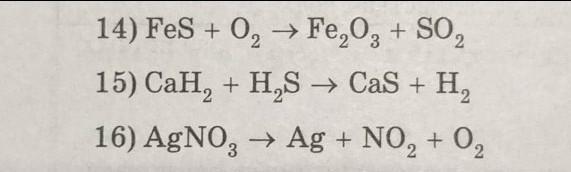
Ответы
В скобках расписаны степени окисления, число после элемента, не в скобках- индекс. Число перед элементом - коэффициент.
Запишем реакцию, расставим степени окисления.
14) Fe(+2)S(-2)+O2(0)= Fe2(+3)O3(-2) +S(+4)O2(-2)
Доп-ные пояснения'
Железо в соединении FeS имеет степень окисления -2, т.к в этом соединении железо проявляет себя как двухвалентное.
O2 это молекула, состоящая из двух атомов, мы это учитываем, когда расписываем присоединение/отсоединение электронов.
Приступим ко второму этапу:
Fe(+2) - ē => Fe(+3) 1|1 окисление/восстановитель.
S(-2) - 6ē => S(+4) 6|4
окисление/восстановитель.
O2(0) + 2*2ē => 2O(-2) 4|6
восстановление/окислитель.
Теперь уравниваем, следуя по нашим действиям выше.
2FeS+ 7O2 = 2Fe2O3+4SO2
Почему перед О2 коэффициент 7, хотя по овр у нас получилось 6? Это редкое исключение, поэтому уравнивая, стоит делать самопроверку.
15)16) на фотографии.
