Предмет: Химия,
автор: fcgghh
Можете, пожалуйста, объяснить как решать такие задачи.
Приложения:

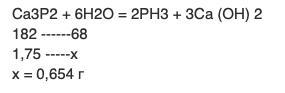
Слишком круто округлили количество фосфида кальция.
Ответы
Автор ответа:
1
Ответ:
m(PH₃) = 0,65 г.
Объяснение:
Ca₃P₂ + 6H₂O ⟹ 3Ca(OH)₂ + 2PH₃↑
n(Ca₃P₂) = 1,75 г / 182 г/моль = 0,009615 моль
n(PH₃) = 2 · 0,009615 моль = 0,01923 моль
m(PH₃) = 0,01923 моль · 34 г/моль = 0,65 г.
Автор ответа:
1
Ответ:
дано
m(Ca3P2) = 1.75 g
----------------
m(PH3) - ?
1)Составляем УХР
Ca3P2+6H2O-->3Ca(OH)2+2PH3
2) определяем кол - ва в -ва Ca3P2
M(Ca3P2) = Ar(Ca) * 3+Ar(P) * 2 = 40*3+31*2 = 182 g/mol
n(Ca3P2) = m(Ca3P2) / M(Ca3P2) = 1.75 / 182 = 0.0096 mol
3) По УХР мы видем, что кол - ва фосфина в 2 раза больше , чем фосфида кальция
n(Ca3P2) = 2n(PH3) отсюда
n(PH3) = 2*0,0096 = 0.0192 mol
4) Определяем массу фосфина
M(PH3) = Ar(P) + Ar(H)*3 = 31+1*3 = 34 g/mol
m(PH3) = n(PH3) * M(PH3) = 0.0192 * 34 = 0.6528 g
ответ 0.6528 гр
Объяснение:
Похожие вопросы
Предмет: Русский язык,
автор: bpmn2015
Предмет: Английский язык,
автор: taisltaly
Предмет: Русский язык,
автор: maksimkorotaev
Предмет: География,
автор: Vikalapachka
Предмет: Математика,
автор: Homwork
(n(Ca3P2) = 1,75/182 = 0,01 моль
по уравнению реакции n(PH3) = 0,01*2 = 0,02 моль
m(PH3) = 0,02*34 = 0,68 г).
В задачнике, как и в прикреплённом ответе , масса фосфина 0,65 г.