Предмет: Химия,
автор: justjuans666
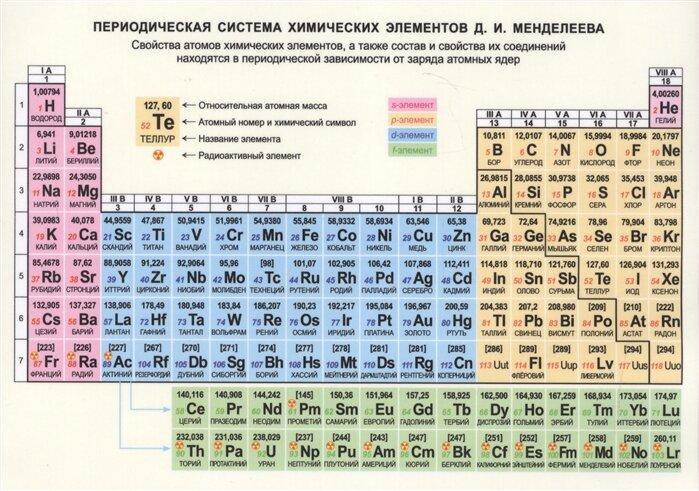
Вот объясните я всегда считал что энергетические уровни заполняются вот по такому принципу 2n² и электроны не могут перескочить на другие уровни пока не заполнят предыдущий но во многих элементов это не так к примеру скандий 1(2) 2(8) 3(9) 4(2) а я думал будет так 1(2) 2(8) 3(11)
Ответы
Автор ответа:
1
Ответ:
Энергетические уровни делятся на подуровни (s, p, d, f). На первом уровне есть только s-орбиталь (2 электрона), на втором уровне есть s- и p- подуровни (2+6=8 электронов), на третьем уровне к s- и p- прибавляется d-подуровень. Но этот 3d-подуровень начинает заполнятся только после 4s-подуровня (энергия у 3d больше). Таким образом электронная формула скандия будет выглядеть как 2, 8, 9, 2 или 1s²2s²2p⁶3s²3p⁶4s²3d¹, и это хорошо видно по таблице Менделеева:
Приложения:
Похожие вопросы
Предмет: Английский язык,
автор: школяр25
Предмет: Английский язык,
автор: Улив200411
Предмет: Русский язык,
автор: панда005
Предмет: Математика,
автор: tanyarunkova99
Предмет: Русский язык,
автор: xadizatm483