Предмет: Химия,
автор: ulyanasad
Решите задачи:
Какая масса оксида кальция получится при разложении 250 кг карбоната кальция, содержащего 20% примесей? Какой объем (н.у.) оксида углерода (IV) выделится при этом?
При растворении в избытке разбавленной серной кислоты цинка, содержащего 4,5% нерастворимых примесей, выделилось 2,24 л (н. у.) водорода. Определить массу исходного образца металла, содержащего примеси.
Ответы
Автор ответа:
0
Ответ:
1)
СаСО3 = СаО + СО2 Масса чистого СаСО3 = 250 кг * 0,8 = 200 кг М (СаСО3) = 100 г/моль или 100 кг/кмоль М (СаО) = 56 г/моль или 56 кг/кмоль Составляем пропорцию Из 100 кг СаСО3 получится 56 кг СаО Из 200 кг - Х Х = 112 кг
обьем на картинке
2 задача на картинке
Приложения:
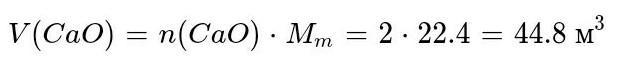

Похожие вопросы
Предмет: Русский язык,
автор: 2020888888
Предмет: Русский язык,
автор: диля62
Предмет: Русский язык,
автор: lerasorrow
Предмет: Алгебра,
автор: katelebedeva200
Предмет: Математика,
автор: youghurt2781