Предмет: Химия,
автор: ogonik650
Задана следующая цепочка превращений:
P→Mg3P2→PH3→P2O5→H3PO4→k3PO4→Ca3(PO4)2.
Запиши уравнения химических реакций, представленных в этой цепочке. Для уравнения 1 расставь коэффициенты методом электронного баланса. Укажи окислитель и восстановитель.
Ответы
Автор ответа:
1
Ответ:
Объяснение:
0 0 +2 -3
1) 3Mg+ 2P = Mg₃P₂
2| P⁰ +3e → P⁻³ | восстановление
3| Mg⁰ -2e → Mg⁺² | окисление
P является окислителем, Mg является восстановителем.
2) Mg₃P₂ + 6H₂O = 3Mg(OH)₂ + 2PH₃
3) 2PH₃ + 4O₂(изб.) = P₂O₅ + 3H₂O
4) P₂O₅ + 3H₂O = 2H₃PO₄
5) 3KOH + H₃PO₄=K₃PO₄ + 3H₂O
6) 2K₃PO₄+3Ca(NO₃)₂ = Ca₃(PO₄)₂ + 6KNO₃
Автор ответа:
1
Ответ:
на фото. надеюсь правильно
Объяснение:
Приложения:
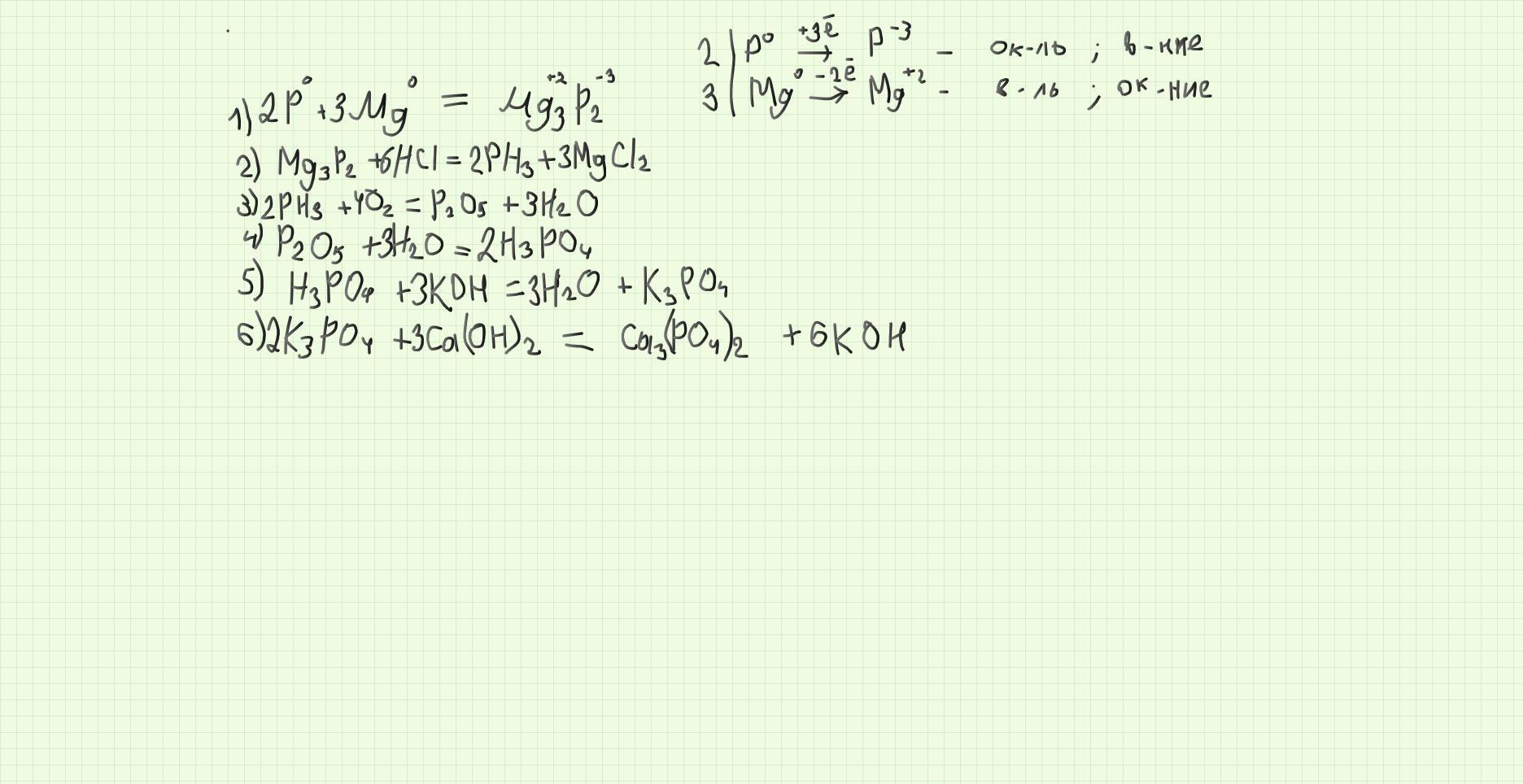
Похожие вопросы
Предмет: Русский язык,
автор: ольга11662
Предмет: Русский язык,
автор: зайя2
Предмет: Окружающий мир,
автор: oleson1980
Предмет: Физика,
автор: natella12
Предмет: Математика,
автор: kravchukuliank