Углеводород, в молекуле которого отсутствуют третичные и четвертичные атомы углерода, содержит 85,7% углерода по массе. Относительная плотность паров этого вещества по метану равна 5,25. Известно, что данное вещество вступает с хлором только в реакцию замещения. Напишите уравнение реакции этого вещества с хлором.
Ответы
Дано:
w(C) = 85,7%
D(в-ва) по метану = 5,25
Найти: формулу вещества
Решение:
Для начала найдём массовую долю водорода в углеводороде:
ᅠᅠ
Пусть масса вещества будет 100 грамм, тогда найдём массы углерода и водорода в соединении:
ᅠᅠ грамм
ᅠᅠ грамм
Найдём количества вещества данных элементов:
ᅠᅠ моль
ᅠᅠ моль
Найдём соотношение между данными количествами вещества:
ᅠᅠ
Исходя из этого соотношения, простейшая молекулярная формула вещества - CH₂. Такое соединение не удовлетворяет условию. Найдём молекулярную массу искомого соединения по относительной плотности:
ᅠᅠ г/моль
Молекулярная масса CH₂ - 14 г/моль, искомого соединения - 84 г/моль. Разница между ними в 6 раз, следовательно домножим все атомы в полученном соединении на 6 и выведем истинную формулу вещества: C₆H₁₂.
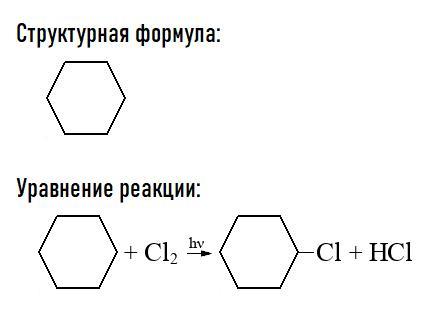
Так как данное соединение не имеет третичных и четвертичных атомов углерода (не содержит заместителей) и не имеет кратных связей (невозможно присоединение), сделаем вывод о том, что это циклогексан (удовлетворяет формуле). Структурная формула и уравнение реакции в приложении снизу.