Сколько граммов Mg2P2O7 образуется с 1 г MgCO3 в результате таких
реакций:
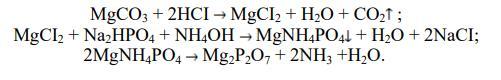
Ответы
Дано:
m(MgCO₃) = 1 гр
------------------------------
Найти:
m(Mg₂P₂O₇) - ?
Решение:
1) Для начала мы запишем уравнений реакций то что вы в результате получили:
MgCO₃ + 2HCl → MgCl₂ + H₂O + CO₂↑ (1)
MgCl₂ + Na₂HPO₄ + NH₄OH → MgNH₄PO₄↓ + H₂O + 2NaCl (2)
2MgNH₄PO₄ (t°C) → Mg₂P₂O₇ + 2NH₃↑ + H₂O (3)
2) Для начла мы найдем количества вещества у карбоната магния, потом у хлорида магния, далее ортофосфат аммония-магния, а потом у пирофосфата магния из уравнений реакций:
M(MgCO₃) = 24 + 12 + 16×3 = 36 + 48 = 84 гр/моль
n(MgCO₃) = m(MgCO₃)/M(MgCO₃) = 1 гр / 84 гр/моль ≈ 0,012 моль ⇒ n(MgCl₂) = n(MgCO₃) = 0,012 моль - из (1) уравнений реакций
n(MgNH₄PO₄) = n(MgCl₂) = 0,012 моль - из (2) уравнений реакций
n(Mg₂P₂O₇) = n(MgNH₄PO₄) = 0,012 моль - из (3) уравнений реакций
3) Теперь находим массу у пирофосфата магния:
M(Mg₂P₂O₇) = 24×2 + 31×2 + 16×7 = 48 + 62 + 112 = 222 гр/моль
m(Mg₂P₂O₇) = n(Mg₂P₂O₇)×M(Mg₂P₂O₇) = 0,012 моль × 222 гр/моль = 2,664 гр ≈ 2,66 гр
Ответ: m(Mg₂P₂O₇) = 2,66 гр