Предмет: Химия,
автор: AsR1eLsanitar
Вычислите объём бурого газа, который образуется при взаимодействии серебра массой 10,8 г. с раствором концентрированной азотной кислоты массой 100г с массовой долей кислоты 63% при нормальных условиях .
Ответы
Автор ответа:
1
Ответ: 18 дм3
Объяснение:
Ag + 2HNO3 = AgNO3+ NO2 + H2O
1) m(раствора) = m(Ag) + m(HNO3) = 10,8 + 100 = 110,8 г
2) n(HNO3) = m(HNO)/M(HNO3) = 100/63 = 1,6 моль
3) Составим и решим уравнение
n(HNO3)/n(NO2) = 1,6 * x/2 * 1 = 0,8 моль
n(NO2) = 0,8 моль
4) V(NO2) = n(VO2) * Vm = 0,8 * 22,4 = 18 дм3
(плиз, отметь как лучший ответ <3 )
Автор ответа:
1
Ответ:
2.24л NO2
-----------------/смотри ниже /
Приложения:
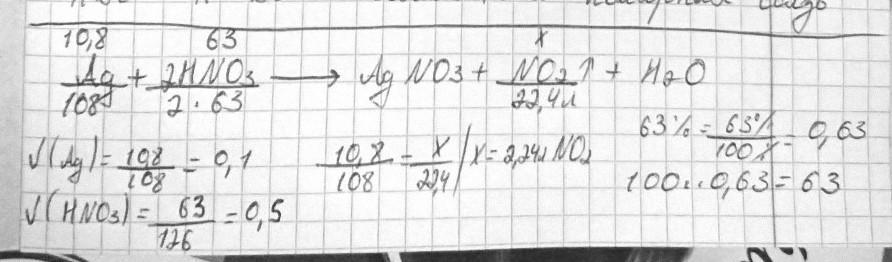
Похожие вопросы
Предмет: Английский язык,
автор: elskw
Предмет: Русский язык,
автор: MadDios
Предмет: Английский язык,
автор: Irishkaa01
Предмет: Алгебра,
автор: Pavel1241