Предмет: Химия,
автор: vashvets364
какая масса оксида кальция получится при разложении 100г карбоната кальция и содержащего 20%примисей
Ответы
Автор ответа:
2
Дано:
m(CaCO3)=100г
Найти:
m(CaO)
Решение:
CaCO3=CaO+CO2
100%-20%=80%=0,8
m(Р.В-ва)=0,8*100=80г
n(CaCO3)=m/M=80г:100г/моль=0,8моль
M(CaCO3)=40+12+16*3=100г/моль
n(CaCO3)=n(CaO)=0,8моль
m(CaO)=n*M=0,8моль*56г/моль=44,8г=45г
M(CaO)=40+16=56г/моль
Автор ответа:
0
Ответ: Держи
Объяснение:
Найдём сначала массу чистого CaCO3, затем его количество вещества. Его количество вещества будет равно количеству вещества CaO, т. к. у них одинаковые коэффициенты. И находим массу оксида по формуле. That's all.
Приложения:
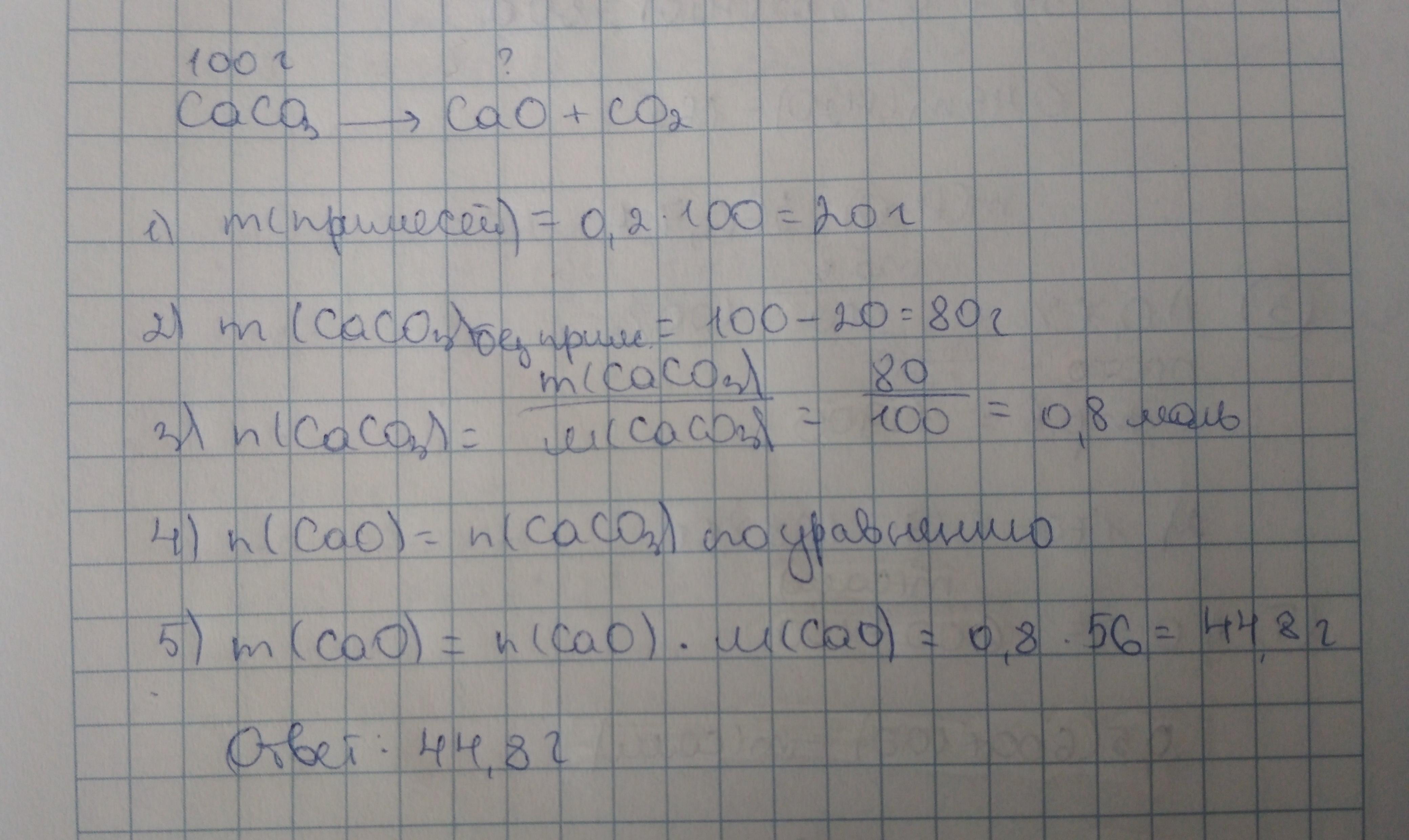
Похожие вопросы
Предмет: Русский язык,
автор: prta77
Предмет: Русский язык,
автор: 13няшка
Предмет: Русский язык,
автор: oliakalinina32
Предмет: Русский язык,
автор: gantik6