Предмет: Химия,
автор: rahmanovartem79
Найдите массу 5% раствора серной кислоты, необходимого для нейтрализации 28.5 г 3% раствора гидроксида бария
Приложения:
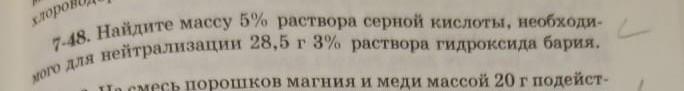
Ответы
Автор ответа:
1
Дано:
m1(Ba(OH)2)=28,5г
w(Ba(OH)2)=3%
w(H2SO4)=5%
Найти;
m(H2SO4)=?
Решение:
Ba(OH)2+H2SO4=BaSO4+2H2O
m(Ba(OH2)=m1×w/100=28.5×3%/100=0.855г
M(Ba(OH)2)=137+(16+1)×2=137+34=171 г/моль
n(Ba(OH)2)=m/M=0.855 г/ 171 г/моль=0.005 моль
M(H2SO4)=2+32+64=98г/моль
m(H2SO4)=98г/моль×0.005моль=0.49 г
m раствора(H2SO4)=m×100%/w= 0.49г× 100% /5% = 9.8 г
Ответ: m раствора(H2SO4)=9.8г
Автор ответа:
1
H₂SO₄+Ba(OH)₂=BaSO₄↓+2H₂O
m(Ba(OH)₂)=28.5×3÷100=0.855г.
n(Ba(OH)₂)=0.855г.÷171г/моль=0.005моль
n(H₂SO₄)=0.005моль
m(H₂SO₄)=0.005моль×98г/моль=0.49г.
m(раствор)=0.49×100÷5 ⇒m(раствор)=9.8г.
Похожие вопросы
Предмет: Математика,
автор: berezeen2
Предмет: Математика,
автор: ministreli1
Предмет: Русский язык,
автор: rnhadjinova
Предмет: Литература,
автор: Аноним
Предмет: Математика,
автор: луина2