Предмет: Химия,
автор: katerinakirsan
У углеводорода содержащего 85,75% C и 14,28%H плотность паров по водороду равна 35. Установите его молекулярную формулу. Напишите и назовите все изомеры такого состава.
Ответы
Автор ответа:
1
Дано:
w(C)= 85,75%
w(H)= 14,28%
Dh2 (CxHy)= 35
Найти:
СхНу- ?
Решение.
Пусть вещество 100г. следовательно
m(C)= 85,75г.
n= m/M
n(C)= 85,75г÷ 12г/моль= 7, 146моль
m(H)= 14,28г
n(H)= 14,28г÷ 1г/моль= 14,28моль
х : у= 7, 146моль : 14,28моль(делим на наименьшее число)= 1моль : 2моль
Простейшая формула:
СН2
Dh2(CxHy)= 2г/моль× 35= 70г/моль
M(CH2)= 12г/моль× 1моль+ 1г/моль× 2моль= 14г/моль<70г/моль в 5 раз
Истинная формула:
С5Н10
Изомеры на фото, вроде написала все.
Приложения:
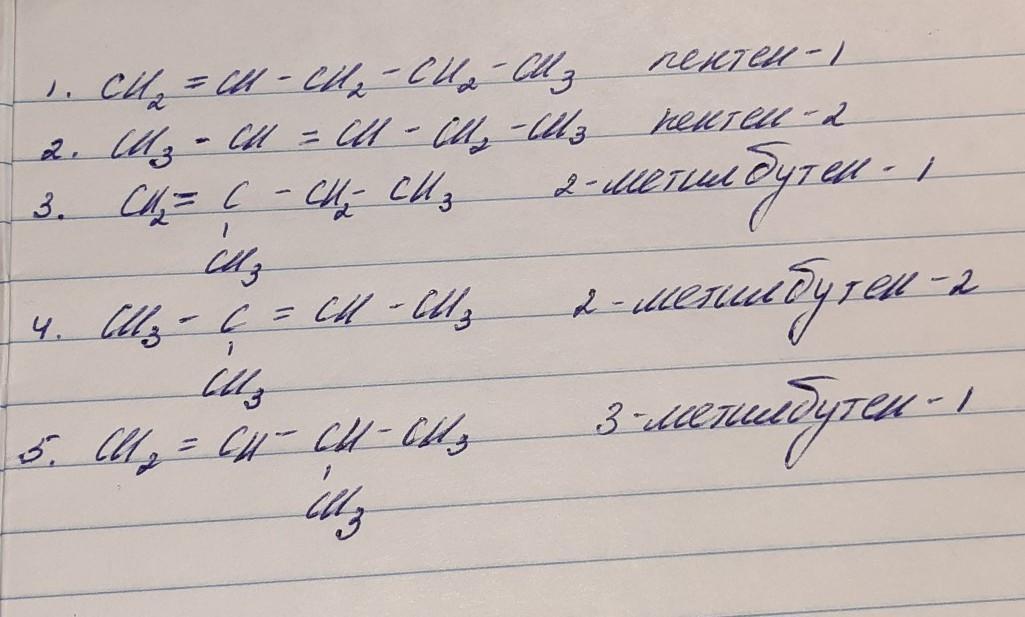
nleMale:
Пожалуйста помоги с химией у меня в профиле, пожалуйста там легко просто я плохо знаю химии
Похожие вопросы
Предмет: Английский язык,
автор: 4680
Предмет: Русский язык,
автор: mmailrushka
Предмет: Русский язык,
автор: вививилка
Предмет: Алгебра,
автор: Doka081
Предмет: Алгебра,
автор: Мона18