Предмет: Химия,
автор: alena28027
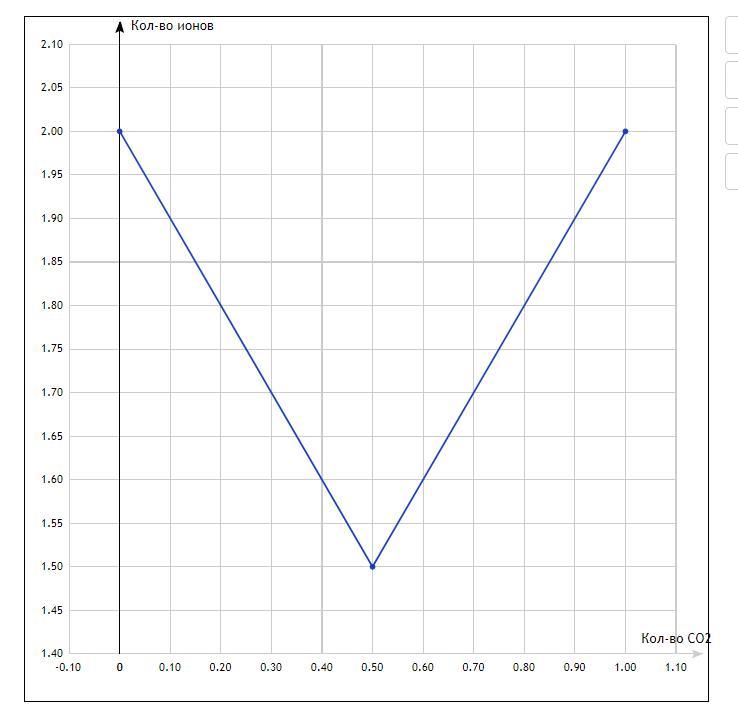
Через раствор, содержащий 1 моль гидроксида натрия, сначала пропустили 0,5 моль углекислого газа, а потом еще 0,5 моль. Сколько всего молей ионов содержалось в растворе а) до реакции б) после пропускания первой порции газа в) после пропускания второй порции ( гидролиз солей и диссоциацию угольной кислоты не рассматривайте) постройте график зависимости общего числа молей ионов в растворе от количества углекислого газа, пропущенного через раствор
Ответы
Автор ответа:
0
Ответ:
Найдем количество ионов до реакции:
У нас имелся один моль гидроксида натрия, который при диссоциации дает 2 моль ионов:
NaOH = Na⁺ + OH⁻
Далее пропускается углекислый газ 0,5 моль через раствор щелочи с образованием карбоната и воды:
2NaOH + CO2 = Na2CO3 + H2O
2Na⁺ + 2OH⁻ + CO2 = Na2CO3 + H2O
2OH⁻ + CO2 = CO3 ²⁻ + H2O
В ходе реакции остается 1,5 моль ионов из 1 моль ионов Na⁺ и 0,5 моль ионов CO3²⁻
После второго пропускания CO2 0,5 моль образуется 1 моль гидрокарбоната натрия:
Na2CO3 + CO2 + H2O = 2NaHCO3
2Na⁺ + CO3²⁻ + CO2 + H2O = 2Na⁺ + 2HCO3⁻
CO3 ²⁻ + CO2 + H2O = 2HCO3⁻
Таким образом в растворе содержится 2 моль ионов в равном соотношении ионов Na⁺ и ионов HCO3⁻
Объяснение:
Приложения:
Похожие вопросы
Предмет: Русский язык,
автор: ana1992
Предмет: Русский язык,
автор: lizakozhevniko
Предмет: Другие предметы,
автор: zhdilia
Предмет: Математика,
автор: ROMANCHEK
Предмет: Математика,
автор: remo444999