Предмет: Химия,
автор: erenchenko456
Оксид меди (II), взятый в избытке, поместили в колбу с 200 г 7%-ой серной
кислоты и смесь нагрели. Вычислите массу сульфата меди (II),
получившегося в результате реакции.
Ответы
Автор ответа:
5
Ответ:
CuO + H2SO4= CuSO4 + H2O
Объяснение:
Приложения:
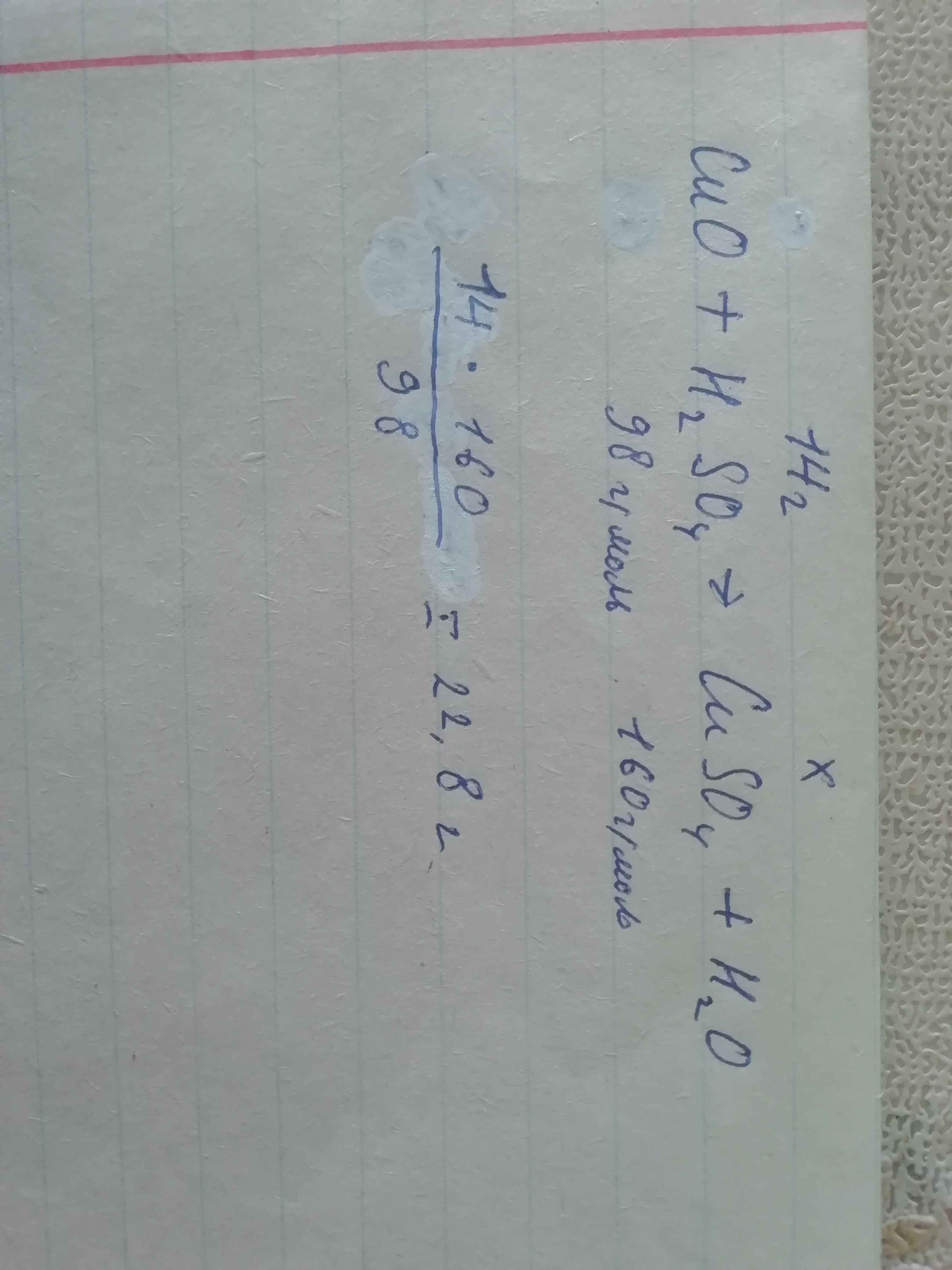
Автор ответа:
4
Ответ:
Объяснение:
H2SO4 + CuO (избыток) = СuSO4 + H2O
Масса 7% раствора серной кислоты 200 г. Найдем массу серной кислоты: 200 г х 0,07 = 14 г. Количество вещества серной кислоты составит: 14 г : 98 г/моль = 0,143 моль (округленно)
Следовательно, и сульфата меди(II) будет получено также 0,143 моль.
Молярная масса сульфата меди(II) равна 160 г/моль.
Найдем массу СuSO4
m(СuSO4) 160 г/моль х 0,143 моль = 22,8 г
Похожие вопросы
Предмет: Математика,
автор: 123Алёнка123
Предмет: Литература,
автор: lidik74
Предмет: Математика,
автор: LeraKrylova
Предмет: Информатика,
автор: anna01100