Предмет: Химия,
автор: aniasif
Ковалентная хим.связь.Помогите пожалуйста!
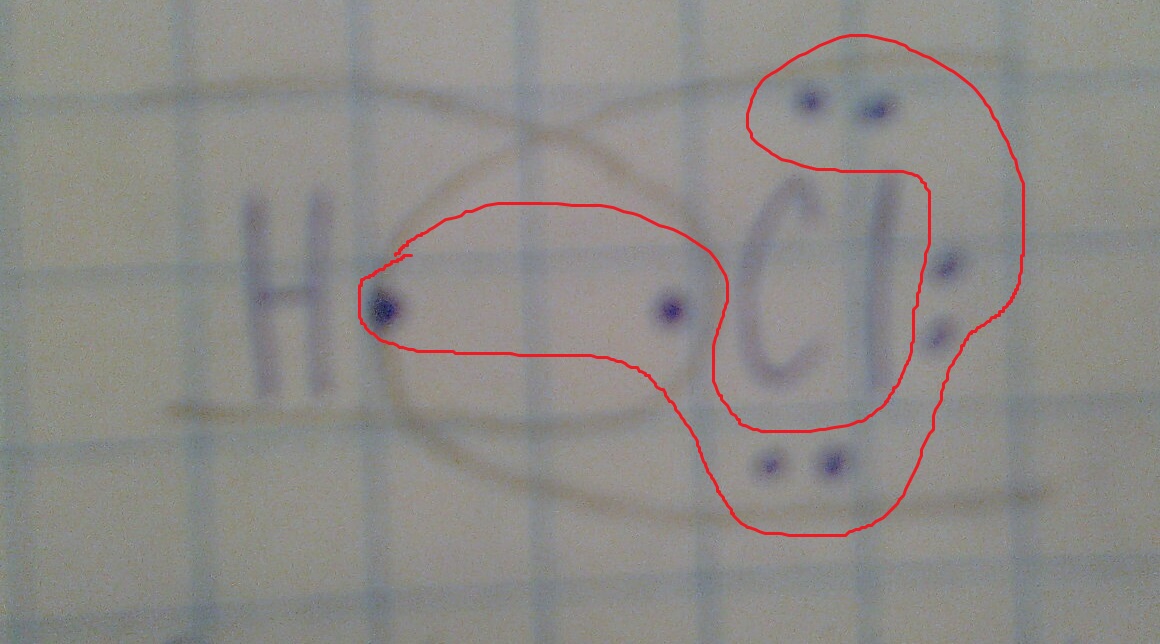
Откуда берутся эти точки возле элемента и почему в связи всего 2 электрона?
Приложения:
Ответы
Автор ответа:
0
ну давай попробую объяснить
1)надо определить в какой группе находится элемент(это необходимо для того, что бы узнать кол-во электронов, которые вращаются вокруг ядра)
H-элемент 1 группы, следовательно у него только один электрон
Cl-элемент 7 группы, следовательно вокруг ядра вращается семь электронов
это понятно?
2) определяем кол-во неспаренных электронов(для этого из 8 надо вычесть номер группы.
у водорода считать нечего т.к. электрон всего один.
считаем хлор
из 8 вычитаем семь и получаем 1
тот самый один неспаренный электрон, который должен соединиться с электроном водорода
пишем
H:Cl(между ними два электрона. один водорода, а другой хлора. вместе они образуют общую электронную пару, но у хлора есть еще и 6 спаренных электронов. их мы точками показываем с других сторон(так как это показано у Вас на рисунке)
обращайтесь если что)
1)надо определить в какой группе находится элемент(это необходимо для того, что бы узнать кол-во электронов, которые вращаются вокруг ядра)
H-элемент 1 группы, следовательно у него только один электрон
Cl-элемент 7 группы, следовательно вокруг ядра вращается семь электронов
это понятно?
2) определяем кол-во неспаренных электронов(для этого из 8 надо вычесть номер группы.
у водорода считать нечего т.к. электрон всего один.
считаем хлор
из 8 вычитаем семь и получаем 1
тот самый один неспаренный электрон, который должен соединиться с электроном водорода
пишем
H:Cl(между ними два электрона. один водорода, а другой хлора. вместе они образуют общую электронную пару, но у хлора есть еще и 6 спаренных электронов. их мы точками показываем с других сторон(так как это показано у Вас на рисунке)
обращайтесь если что)
Автор ответа:
0
Значит так. Ковалентная связь образуется за счет неспаренных электронов. Общее количество электронов на последнем энергетическом уровне узнаем по № группы для элементов главных подгрупп. Например !А - у всех этих элементов 1электрон на внешнем энерг. уровне. В 7А - 7 электронов Неспаренные узнают по формуле 8 - № группы. Итак 7А Всего 7 электронов на внешнем энерг. уровне, а неспаренных, или валентных 8 - 7 = 1, остальные 6 /2 =3 это пары, и только один е-, будет принимать участие в образовании связи, но одного недостаточно нужен еще такой же неспаренный электрон и тогда они одразуют связь. Напрмер у азота. Группа 5А, 8-5= 3 неспаренных электрона, нужен еще такой же элемент азот, у него тоже 3 неспаренных е-. значит всего 6/2 3 это будет тройная связь, у кислорода 8-6 = 2 е- неспаренных, значит в молекулеО2 двойная связь.
Похожие вопросы
Предмет: Физика,
автор: vicas21
Предмет: Математика,
автор: Аноним
Предмет: Химия,
автор: dedok4267
Предмет: География,
автор: yana11052001