ПОМОГИТЕ СРОЧНООООООООО ПОАЛУЙСТАААААА ЧТОБЫ ВСЕ ВСЕ БЫЛО ПРАВИЛЬНОООООО

2Al + 3Cl2 = 2AlCl3
2Al + 3S = Al2S3
2Al + 6HСl = 2AlCl3+ 3H2 (газ)
2Al + 2NaOH+6H2O = 2Na{Al(OH)4}+ 3H2 (газ)
2Al +6 NaOH = 2Na3AlO3+3H2 (газ)
Ответы
Ответ:
Объяснение:
1.
1) Название элемента –алюминий химический символ - AI, порядковый номер - № 13 , атомная масса Ar=27. Группа - 2, подгруппа- главная , 3-й период.
Заряд ядра атома алюминия Z=+13 (в ядре 13 p⁺(протонов) и 14 n⁰ (нейтронов).
Вокруг ядра атома 3 энергетических уровня, на которых располагаются 13 электрона.
3) Исходя из вышеизложенного
Напишем модели (схемы) строение атома алюминия:
а). Модель атома алюминия при помощи дуг: ₊₁₃AI)₂)₈)
б). Модель атома, электронная формула алюминия (электронная конфигурация): ₊₁₃AI 1s²2s²2p⁶3s²3 p¹
в).Электронно-графическая модель атома алюминия:
p ↑
3уровень s ⇵
p ⇅ ⇅ ⇅
2уровень s ⇅
1уровень s ⇅
₊₁₃AI
4. Простое вещество алюминий металл, состоит из одного атома , валентность алюминия в соединениях равна 3, степень окисления+3 . Алюминий –восстановитель.
5. Молекулы атомов в 2 группе, главной подгруппе одноатомные. С увеличением заряда ядра от бериллия до радия неметаллические свойства уменьшаются, а металлические усиливаются.
6.Молекулы атомов простых веществ в третьем периоде: натрий, магний, алюминий, кремний - одноатомные; фосфора четырехтомные P₄ принято записывать P, серы многоатомные (S)n принято записывать S, хлора двухатомные CI₂. От натрия к хлору меняются свойства веществ: натрий, магний - металлы, алюминий - амфотерный металл, кремний полуметалл, фосфор, сера, хлор - неметаллы. Также слева направо в периоде меняются окислительно-восстановительные свойства. Натрий, магний, алюминий - восстановители. Кремний, фосфор, сера, хлор - могут быть как восстановителями, так окислителями.
7. Формула высшего оксида: Al₂O₃ – амфотерный оксид.
8. Формула гидроксида: Al(OH)₃ гидроксид алюминия, амфотерный гидроксид- основание нерастворимое в воде.
9. Летучего соединения с водородом не образует, а соединение алюминия с водородом - это гидрид алюминия AIH₃ -Представляет собой твёрдое белое нелетучее вещество.
2.
с простыми:
4AI+3O₂=2AI₂O₃
2AI+3CI₂=2AICI₃
2AI+3S=AI₂S₃
со сложными:
AI+H₂O=AI(OH)₃+H₂↑
AI+HCI=AICI₃+H₂↑
2AI+2NaOH+6H₂O=2Na[AI(OH)₄]+3H₂↑
2AI+6NaOH=2Na₃AIO₃+3H₂↑
AI+ZnSO₄=AI₂(SO₄)₃+Zn↓
2AI+Fe₂O₃=AI₂O₃+2Fe↓
Сходство с металами:
-металлическая связь
-металлическая кристаллическая решетка
- пластичность
- обладает электропроводностью и теплопроводностью
Специфические свойства:
Металл серебристо-белого цвета, лёгкий ,
плотность — 2712 кг/м, температура плавления у технического алюминия — 658 °C, у алюминия высокой чистоты — 660 °C.
Амфотерность алюминия (двойственность) может взаимодействовать, как с кислотами: AI+HCI=AICI₃+H₂↑
так и со щелочами: 2AI+2NaOH+6H₂O=2Na[AI(OH)₄]+3H₂↑
2AI+6NaOH=2Na₃AIO₃+3H₂↑
Задание:
1)
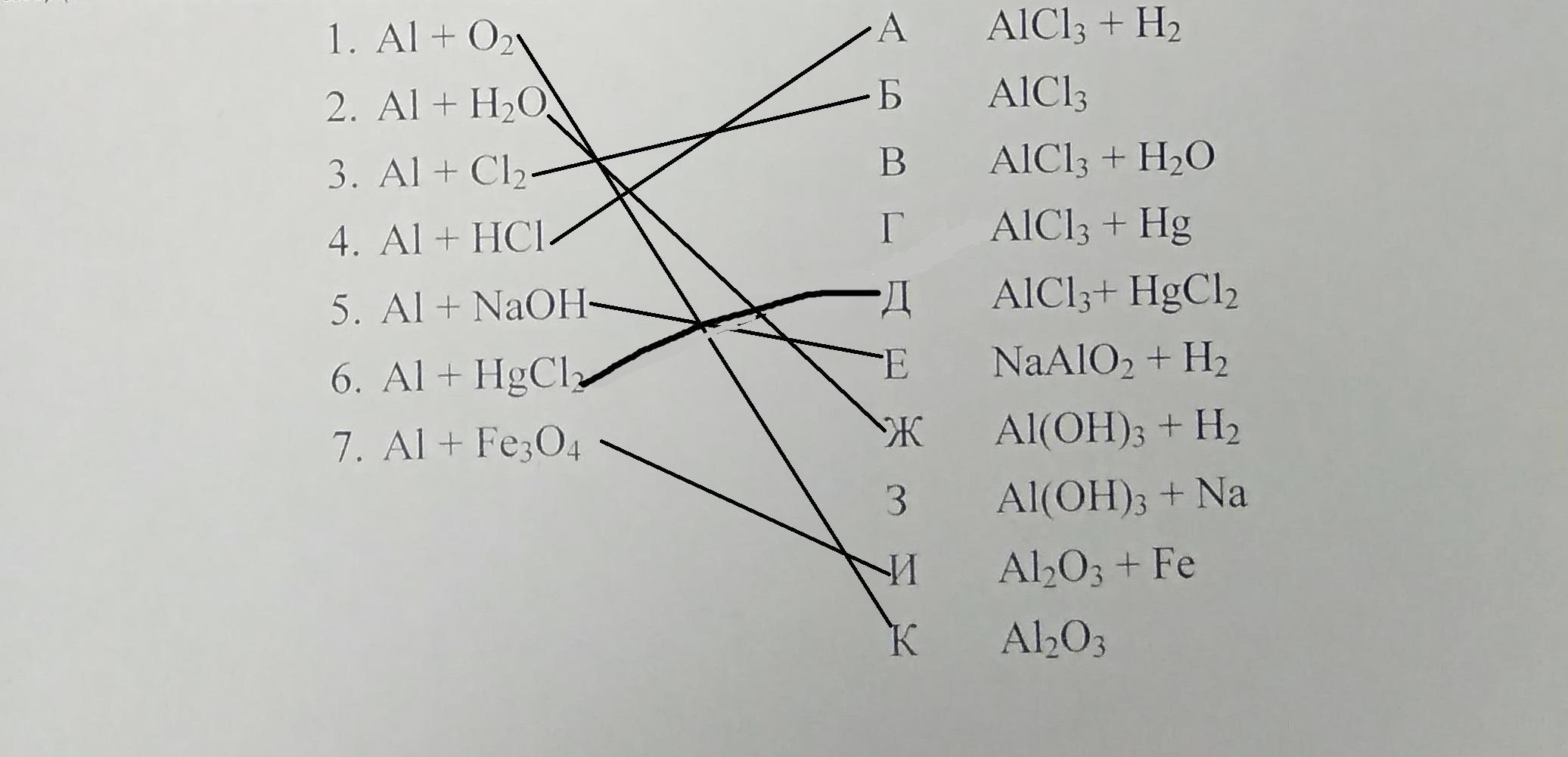
1. AI+O₂= К AI₂O₃
2 AI+H₂O= Ж AI(OH)₃+H₂
3. AI+CI₂= Б AICI₃
4.AI+HCI= А AICI₃+H₂
5.AI+NaOH=Е NaAIO₂+H₂
6. AI+HgCI₂= Г AICI₃+Hg
7.AI+Fe₂O₃= И AI₂O₃+Fe
2).
AI→AIBr₃→AI(OH₃)→AI(NO₃)₃
2AI+3Br₂=2AIBr₃
AIBr₃+3NaOH=AI(OH₃)↓+3NaBr
AI(OH₃)+3HNO₃=AI(NO₃)₃+3H₂O
1. Аллюминий
Порядковый номер 13
Группа 13 по новой классификации
Период 3, ряд 3, группа 3, подгруппа а по старой классификации
3 электронных уровня
распределение электронов по уровню : 1 уровень – 2, 2 ур – 8, 3 ур -3
1 s2 2 s2 3p63s2 3p1
Атомная масса 26,98
2 Почему аллюминий рекордсмен? Аллюминий самый распространенный металл в земле. Он легко поддается обработке, электропроводен, легкий по весу, не токсичен, стоек к коррозии, так на его поверхности образуется пленка из оксида, которая защищает металл от коррозии.
4Al + 3O2 =2Al2O3
2Al + 3Cl2 = 2AlCl3
2Al + 3S = Al2S3
2Al + 6H2O = 2Al(OH)3 (осадок)+ 3H2 (газ)
2Al + 6HСl = 2AlCl3+ 3H2 (газ)
2Al + 2NaOH+6H2O = 2Na{Al(OH)4}+ 3H2 (газ)
2Al +6 NaOH = 2Na3AlO3+3H2 (газ)
2Al+ 3CuSO4= Al2(SO4)3+ 3Cu
3. Как остальные металлы алюминий плавкий, ковкий, электропроводный, теплопроводный, пластичный, не магнитится. Как прочие металлы взаимодействует с кислородом, кислотами, галогенами
Особые свойства аллюминий - амфотерность, то есть он взаимодйствует как металл с кислотами с образованием солей и как неметалл реагирует с основаниями, с образованием кмплексных соединений или солей аллюминиевой кислоты - алюминатов
амфотерность - это свойство элемента вести себя в реакция как металл и как не металл, то есть проявлять кислотные и основные свойства в зависимости от условий
Цепочка превращений
2Al + 3Br2 = 2AlBr3
2AlBr3 + 3Na2CO3 + 3H2O = 2Al(OH)3↓ + CO2↑ + 6NaBr
Al(OH)3 + 3HNO3 → Al(NO3)3 + 3H2O
Соответствие 1К 2Ж 3Б 4А 5Е 6Д 7Н
Порядковый номер 13
Группа 13 по новой классификации
Период 3, ряд 3, группа 3, подгруппа а по старой классификации
3 электронных уровня
распределение электронов по уровню : 1 уровень – 2, 2 ур – 8, 3 ур -3
1 s2 2 s2 3p63s2 3p1
Атомная масса 26,98