Предмет: Химия,
автор: Selina555
Определите x, при сжигании x m=8,6г, образовалось 12,6г воды, 13,44 co2. В фото более точное условие. Помогите пж
Приложения:

Ответы
Автор ответа:
1
Судя по продуктам реакции, горит углеводород с общей формулой СyHz.
По уравнению реакции:
(1) n(CO2) : n(X) = y : 1
(2) n(H2O) : n(X) = z : 2
n(H2O) = m(H2O) / M(H2O) = 12,6 г / 18 г/моль = 0,7 моль
n(CO2) = V(CO2) / Vm = 13,44 л / 22,4 л/моль = 0,6 моль
М(Х) = Д * М(СН4) = 5,375 * 16 г/моль = 86 г/моль
n(X) = m(X) / M(X) = 8,6 г / 86 г/моль = 0,1 моль
Из пропорций:
(1) y = 0,6/0,1 = 6
(2) z = 2*0,7/0,1 = 14
Общая формула: С6Н14 (гексан)
Проверим баланс по молярной массе:
6*12 + 14*1 = 86 (г/моль)
Ответ: С6Н14 — гексан
Приложения:
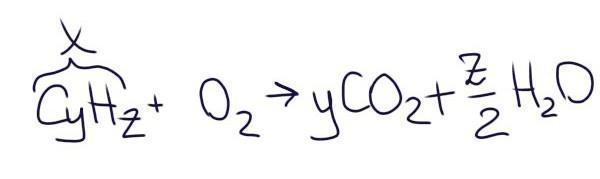
Selina555:
Спасибо огромное!!!!
Похожие вопросы
Предмет: Алгебра,
автор: vsheva631
Предмет: Алгебра,
автор: kate8650
Предмет: Математика,
автор: danaprogame
Предмет: История,
автор: лера8882
Предмет: Математика,
автор: wtankov