Предмет: Химия,
автор: kambarov2004
Сколько литров углекислого газа выделится из Na2CO3 массой 120 г при взаимодействии с соляной кислотой?
Ответы
Автор ответа:
1
Ответ:
запиши там: дано и решение если формула нужна :v/vM=m/M
Приложения:
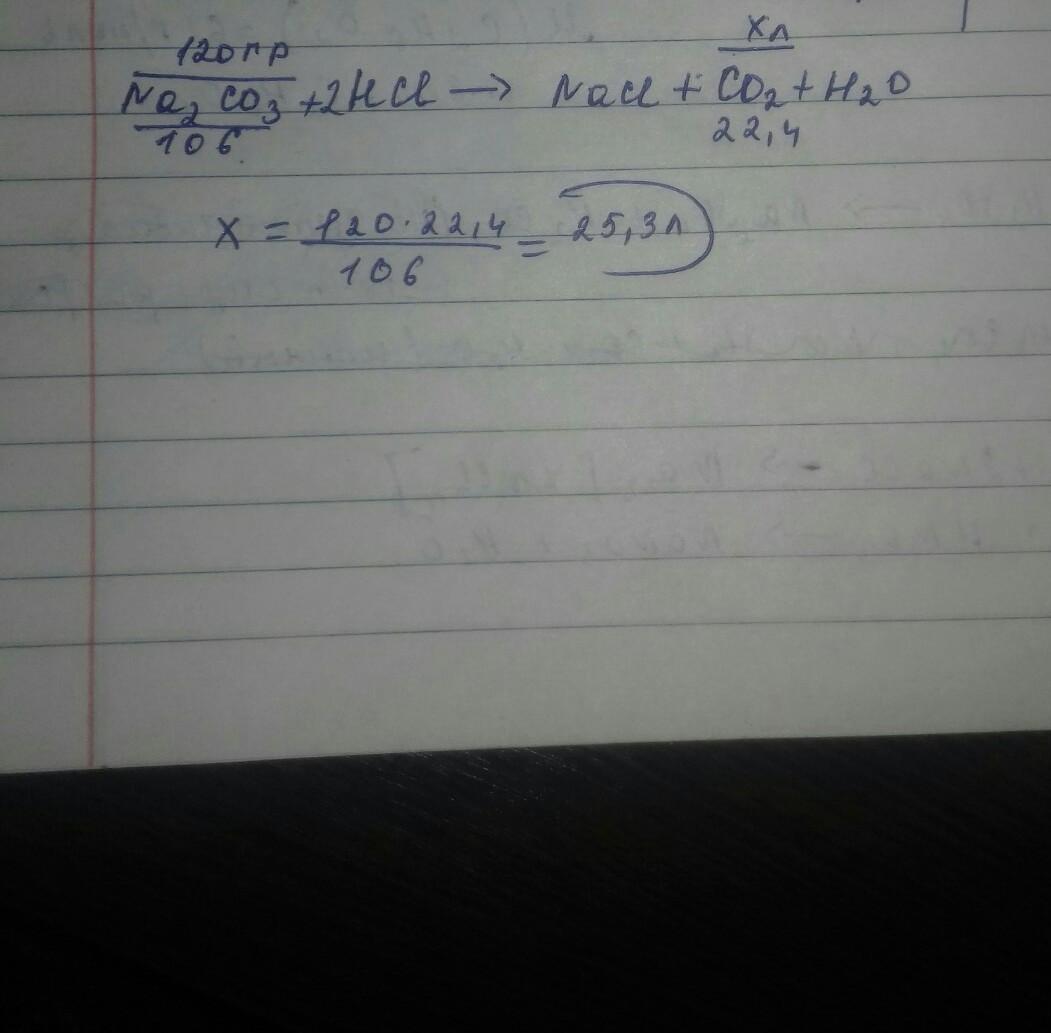
Автор ответа:
1
m(Na2CO3) = 120 г
HCI
V(CO2) = ?
РЕШЕНИЕ Na2CO3 + 2HCI => NaCI + CO2 + H2O
M(Na2CO3) = 23*2+12+16*3 = 106 г/моль
Пропорция
120/106=х/22,4
х=120*22,4/106=25,3л
HCI
V(CO2) = ?
РЕШЕНИЕ Na2CO3 + 2HCI => NaCI + CO2 + H2O
M(Na2CO3) = 23*2+12+16*3 = 106 г/моль
Пропорция
120/106=х/22,4
х=120*22,4/106=25,3л
kambarov2004:
22.4 это молярный объем?
Нет
Ой
Да
Да это молярный объем
да
молярный
Похожие вопросы
Предмет: Русский язык,
автор: Ivanovnaanastasia942
Предмет: Биология,
автор: elenakolanovskaa
Предмет: Русский язык,
автор: mkenig14
Предмет: Информатика,
автор: Марина1419