Предмет: Химия,
автор: nikasubbotina110
По уравнению: Cu(NO3)2, + KCl = CuCl2, + KNO3, определите
массу нитрата меди вступившего в реакцию с 745г хлорида калия.
фтвфкещт20:
подождёшь 2-3-5 минут?
я просто немного занята,другому пишу ответ
хорошо
спасибо)
заранее лучше не благодарить,как тому напишу сразу тебе напишу
хорошо
с тем что то не понятно,допустил ошибку в условии и не отвечает поэтому тебе пишу
всё готово.Рада была помочь.Нажми на спасибо если не трудно
спсаибо за отметку лучшийответ
Ответы
Автор ответа:
1
Ответ:
m(Cu(NO3)2) = 940 г
Объяснение:
Дано :
m(KCl) = 745 г
Найти :
m(Cu(NO3)2) - ?
Cu(NO3)2+2 KCl = CuCl2+2 KNO3
1) n(KCl) = m/M
M(KCl) = 39+35.5 = 74.5 г/моль
n(KCl) = 745 г/74,5 г/моль = 10 моль
n(KCl) = 10 моль
2) n(Cu(NO3)2 10 моль
= =>
1 2
n(Cu(NO3)2) = 5 моль
3) m(Cu(NO3)2) = n*M
M(Cu(NO3)2) = 64+14*2+16*6 = 188 г/моль
m(Cu(NO3)2) = 5 моль * 188 г/моль = 940 г
m(Cu(NO3)2) = 940 г
Ответ : m(Cu(NO3)2) = 940 г
Автор ответа:
2
Объяснение:
Решение на фото..........
Приложения:
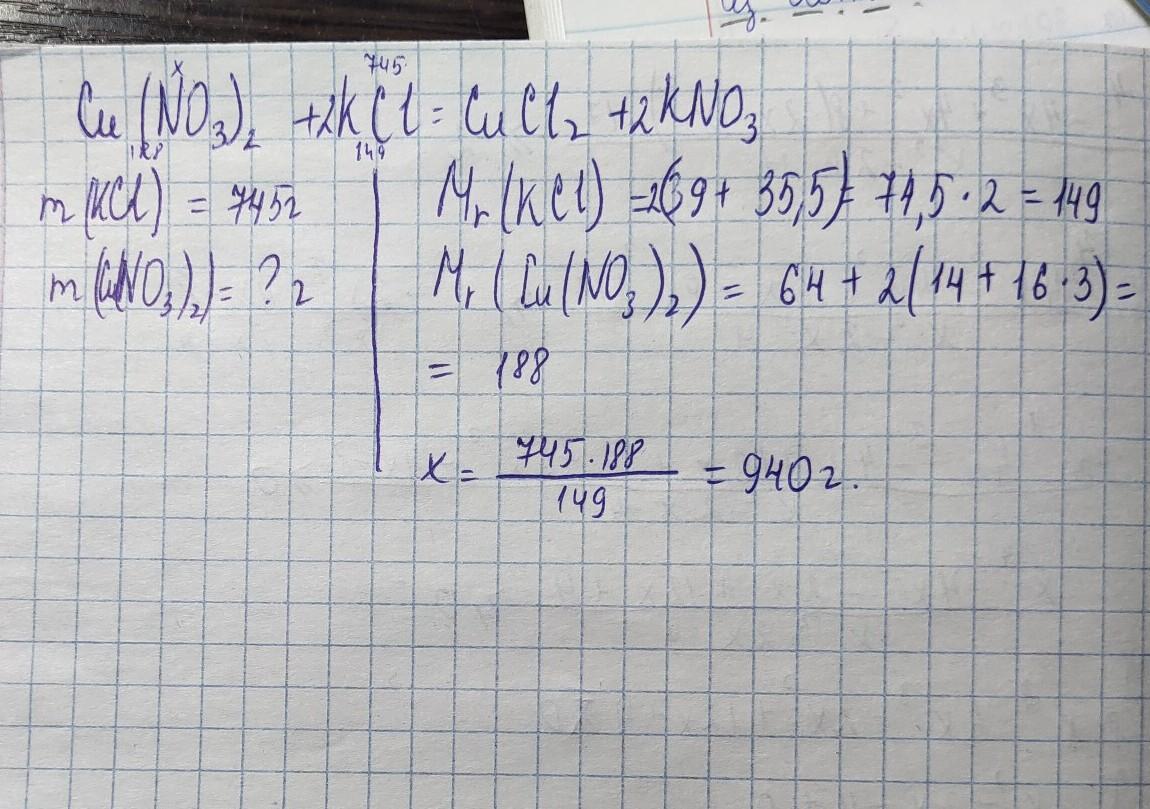
Похожие вопросы
Предмет: Математика,
автор: yanochka1010
Предмет: Математика,
автор: khavasharipova10
Предмет: Английский язык,
автор: medinaerzanova271
Предмет: Алгебра,
автор: ooooorne