Предмет: Химия,
автор: h0x1
Рассчитайте, какой объём раствора с массовой долей гидроксида натрия 8% (p=1,09г/см^3) потребуется для поглощения оксида углерода (IV), образующегося при полном сгорании 11,2 л (н.н.) пропана.
Нужно подробно расписать решение.
Приложения:

Ответы
Автор ответа:
0
686 г, сначала из сгорания, при условии неполного поглощения раствора
Приложения:
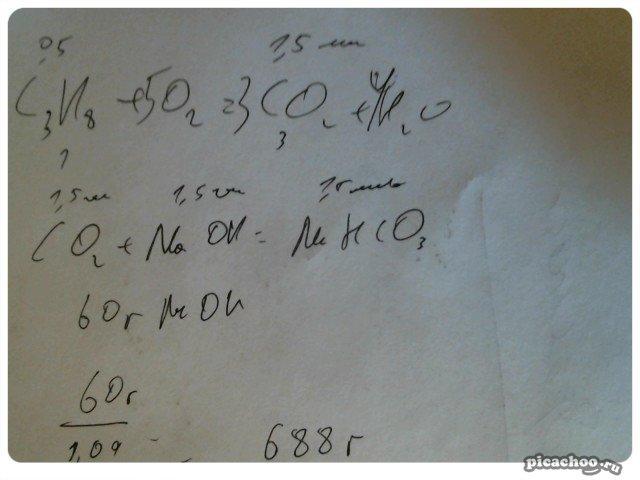
Автор ответа:
0
Ответ:
дано
V(C3H8) = 11.2 L
W(NaOH) = 8%
p(NaOH) = 1.09 g/cm3
--------------------------------
V(ppa NaOH)-?
C3H8+5O2-->3CO2+4H2O
n(C3H8) = 3n(CO2)
V(CO2) = 3n(CO2)*V(C3H8) = 3 * 11.2 = 33.6 L
n(CO2) = V(CO2) / Vm = 33.6 / 22.4 = 1.5 mol
2NaOH+CO2-->Na2CO3+H2O
n(CO2) = n(Na2CO3) = 1.5 mol
M(Na2CO3) = 106 g/mol
m(Na2CO3) = n(Na2CO3) * M(Na2CO3) = 1.5 * 106 = 159 g
m(ppa Na2CO3) = m(Na2CO3) * W(Na2CO3) * p(Na2CO3) / 100%
m(ppa Na2CO3) = 159 * 100% / 8% = 1987.5 g
V(ppa Na2CO3) = 1987.5 / 1.09 = 1823.4 cm3
ответ 1823.4 см3
Объяснение:
h0x1:
Я решил немного по-другому, давайте в собщениях поговорим
Добавил вас в друзья
они уже смотрят, бро
Похожие вопросы
Предмет: Русский язык,
автор: amaraotto93
Предмет: Химия,
автор: shadiya1984
Предмет: Русский язык,
автор: levseev571
Предмет: История,
автор: Аноним
Предмет: Математика,
автор: наталья505