Предмет: Химия,
автор: Typichkin
Вычисли объём водорода, который выделится в результате взаимодействия 9,75 г цинка с раствором H2SO4.
Ответ следует округлить до сотых.
Ответы
Автор ответа:
2
если серная разбавленная ,то вот
Приложения:
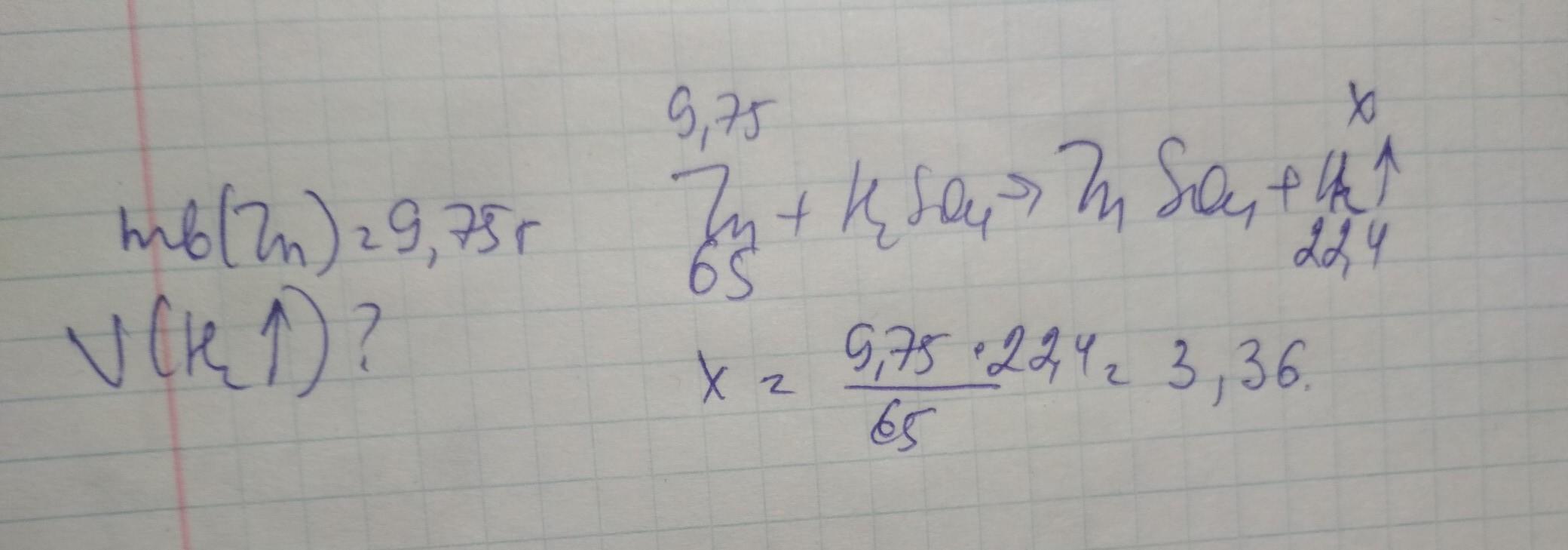
Typichkin:
огромное спасибооо!!!!!
Автор ответа:
13
Ответ: 3,36 л
Объяснение:
Дано:
m(Zn)=9,75 г
Найти:
V(H2)-?
Решение.
M(Zn) = 65 г/моль
n(Zn) = m/M = 9,75 г/65 г/моль = 0,15 моль
Vm = 22,4 л/моль
Zn + H2SO4 = ZnSO4 + H2
Из УХР видно, что n(H2)=n(Zn)
n(H2) = 0,15 моль
V(H2)=n(H2)*Vm = 0,15 моль*22,4 л/моль = 3,36 л
Похожие вопросы
Предмет: Биология,
автор: margaritalvica
Предмет: Геометрия,
автор: v44783223
Предмет: Математика,
автор: Аноним
Предмет: Алгебра,
автор: AnnaIvanova02
Предмет: Алгебра,
автор: olense