Добрый день.Решите две задачи по химии.
1.20 грамм карбоната кальция,опустили в раствор соляной кислоты,при этом образовался хлорид кальция,оксид углерода(iv) и вода. Рассчитайте объем выделившегося оксида углерода (iv).
2.Определи массу сульфата меди (II),полученного при взаимодействии гидроксида меди (ii) с 58,8 г серной кислоты.Срочно!
Даю 95 баллов!
Ответы
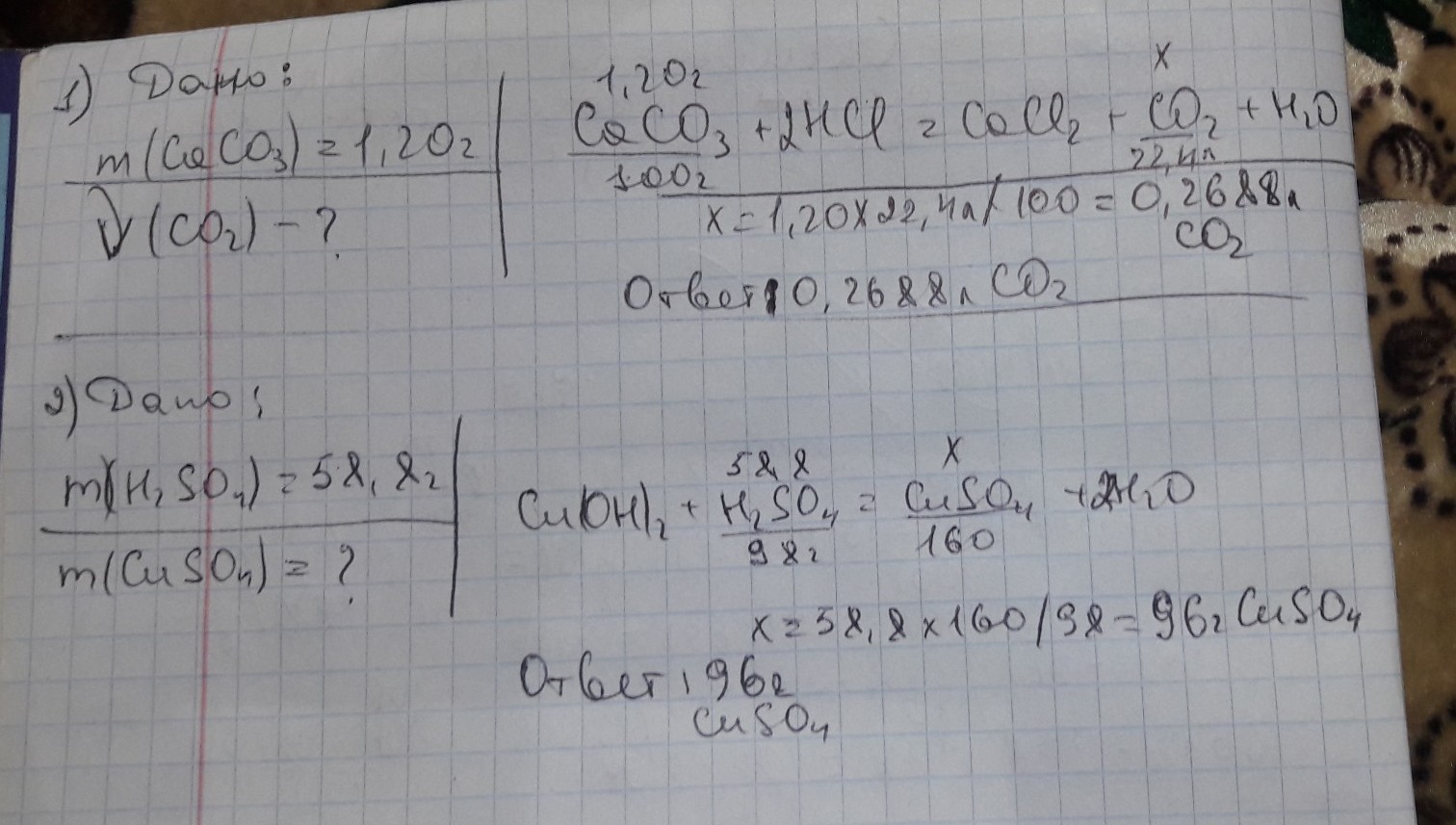
1)
1,20 г Х л
CaCO3 + 2HCl = CaCl2 + CO2 + H2O
n=1 моль n=1 моль
М = 100 г/моль Vm=22,4 л/моль
m=100 г V = 22,4 л
1,20 г СаСО3 - Х л СО2
100 г СаСО3 - 22,4 л СО2
V(CO2) = 1,20 * 22,4 / 100 =0,27 л
58,8 г Х г
2) Cu(OH)2 + H2SO4 = CuSO4 + 2H2O
n=1 моль n=1 моль
М = 98 г/моль М = 160 г/моль
m=98 г m=160 г
58,8 г H2SO4 - Х г CuSO4
98 г H2SO4 - 160 г CuSO4
m(CuSO4) = 58,8 * 160 / 98 =96 г