Предмет: Химия,
автор: smartbutno
Цинк прореагировал со 100 граммами 10-% раствора серной кислоты Н2SO4. Рассчитайте объём водорода, выделившегося в результате реакции.
Ответы
Автор ответа:
1
Zn + H2SO4 => ZnSO4 + H2
m(чист H2SO4) = 100 * 0,1 = 10г
n(H2SO4) = n(H2)
n(H2SO4) = 10г / 98 г/моль ≈ 0,1 моль
n(H2SO4) = n(H2) = 0,1 моль
V(H2) = 0,1 моль * 22,4 л/моль = 2,24 л
Ответ: 2,24 л
Donaticher:
Отмечай как лучшее :)
А как решить эту задачу с использованием W???
0,1 это 10%?
да
Автор ответа:
1
Смотри во вложении)))))
Приложения:
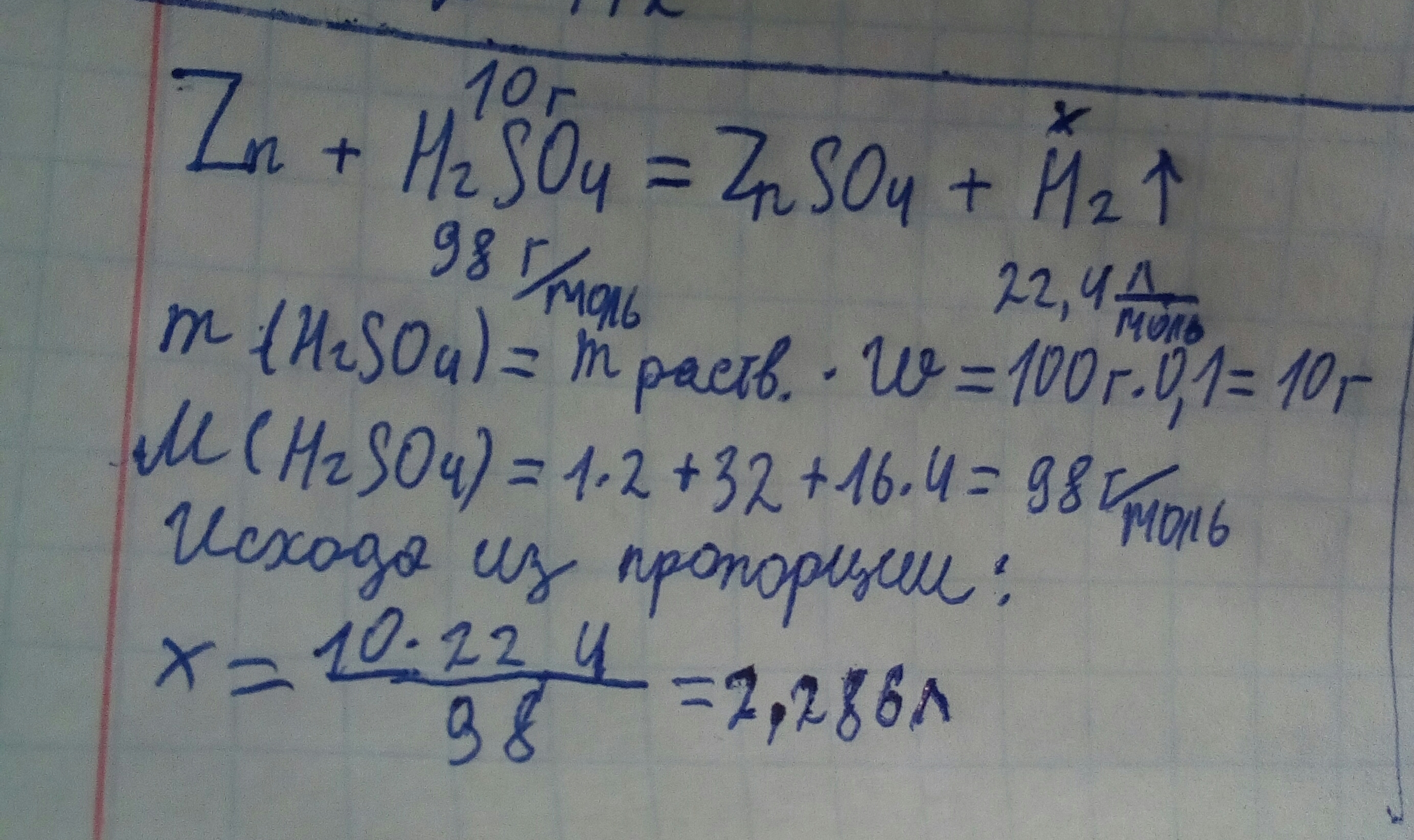
Спасибо, но зачем нам тогда дали 10%???
Все понятно!!
Все понятно, спасибо !
Похожие вопросы
Предмет: Математика,
автор: xzkto3628
Предмет: Английский язык,
автор: gallyamova19972016
Предмет: Русский язык,
автор: htoia88
Предмет: Литература,
автор: алиса491