Предмет: Химия,
автор: berezkoartem13
Найдите массовую долю карбоната натрия в растворе, полученном при растворении 5,72 г кристалла гидрата декагидрата карбоната натрия в 44,28 мл воды.
Ответы
Автор ответа:
2
Массу карбоната в кристаллогидрате лучше всего - по пропорции вычислять:
44.28 г (Na2CO3*10H2O) --------------------267 г/моль
Х г (Na2CO3) --------------------------------106 г/моль
Отсюда Х=(46*106)/286 = 17 г
Масса карбоната в исходном р-ре: m(Na2CO3) = m(р-ра) *w = 420 г*0,13 = 54,6 г
Суммарная масса карбоната (после добавления кристаллогидрата) : 5,72 г + 17 г = 77,6 г
Суммарная масса раствора: 420 г + 44.28 г = 447.06 г
Массовая доля карбоната в конечном р-ре: w(Na2CO3) = m(Na2CO3)/m(р-ра) = 71,6 г/447.06 г = 0,154, или 15,4%
berezkoartem13:
Откуда взялись цифры 420 и 0,13?
Автор ответа:
3
Ця задача як знайти масову частку
Приложения:
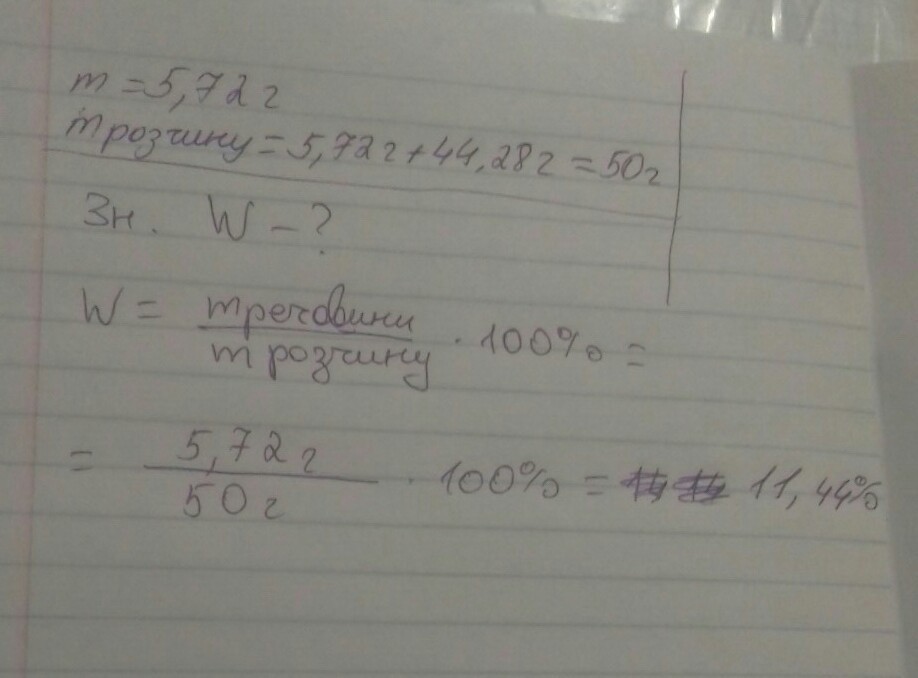
Похожие вопросы
Предмет: Русский язык,
автор: tian19062009
Предмет: История,
автор: dturmusova5367
Предмет: Русский язык,
автор: goldnt2776
Предмет: Математика,
автор: verasko