Помогите с окислительно-восстановительными реакциями. Точнее я их решила, но хотелось бы , чтоб вы проверили.Скажите, есть ли ошибки и если да то какой правельный ответ?
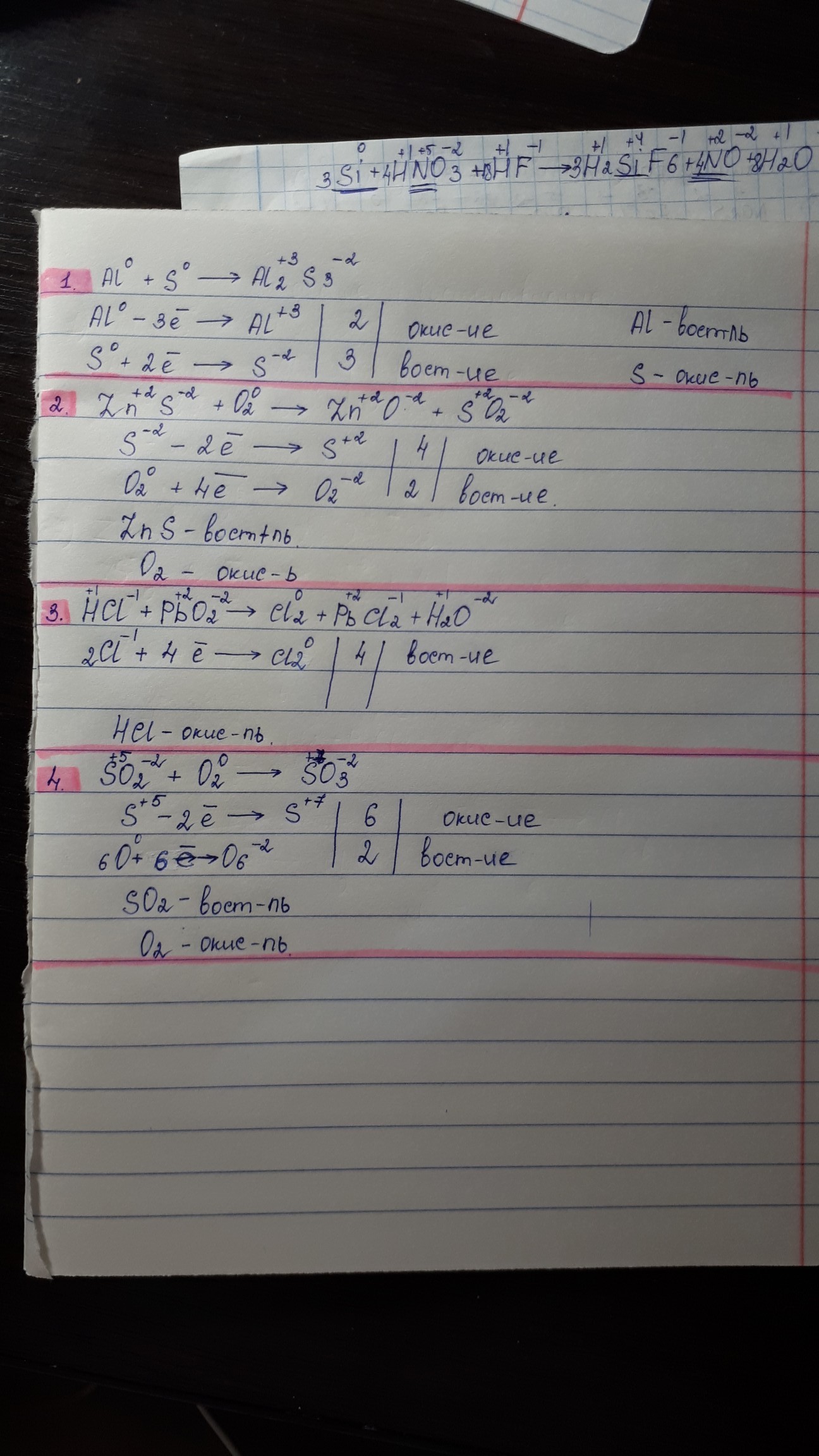
Ответы
1. верно, но в уравнении расставить коэф.
2. S -2 в S +4
коэф в электронном балансе ставят перед элементом так что не О2, а из 2О в 2О
3. 2Cl -1→2Cl 0 (-2e)
Pb(+4)→Pb(+2)
4. S(+4)→ S(+6)
Во второй реакции образуется SO2, где у серы степень окисления +4, а не +2 и кислород со степенью -2.
Соответственно, сера будет отдавать 6 электронов, а кислород 4.
В третьем уравнении похожая ошибка. PbO2 - у плюмбума +4, а у кислорода -2. У вас в сумме должно получаться 0. х*1+(-2)*2=0 х-4=0 х=4 Учитывайте индекс
Значит, у плюмбума поменялась степень окисления, записываете схему передачи электронов. Заметьте, что у вас написано только восстановление. Запомните, что всегда должно быть и окисление, и восстановление. Причём количество принятых электронов должно равняться количеству отданных.
В четвертом: откуда у серы +5 и +7? Должно быть +4 и +6. Ещё раз проработайте. В сумме 0.