Предмет: Химия,
автор: Умник56302
Решить задачу срочно пожалуйста!!!!!!!!!
Воду объёмом 100 мл насыщают нитратом калия KNO3 при 70°С. Раствор охлаждают до 20°С. Какая масса соли выпадает в осадок? Пожалуйста!!!
Ответы
Автор ответа:
4
Дано:
V(H2O) = 100 мл
t₁ = 70°
t₂ = 20°
Найти:
m(KNO3) = ?
Решение.
Найдём массу воды
m(H₂O) = V(H₂O) * p(H₂O) = 100 мл * 1 г/мл = 100 г
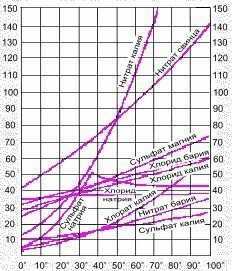
По кривой растворимости (см. в приложении) нитрата калия находим растворимость KNO3 при 70°С и при 20°С.
При 70° растворимость нитрата калия равна 110 г.
При 20° растворимость нитрата калия равна 30 г.
m(KNO3) = 110 г - 30 г = 80 г.
Ответ. 80 г. масса соли выпадает в осадок.
V(H2O) = 100 мл
t₁ = 70°
t₂ = 20°
Найти:
m(KNO3) = ?
Решение.
Найдём массу воды
m(H₂O) = V(H₂O) * p(H₂O) = 100 мл * 1 г/мл = 100 г
По кривой растворимости (см. в приложении) нитрата калия находим растворимость KNO3 при 70°С и при 20°С.
При 70° растворимость нитрата калия равна 110 г.
При 20° растворимость нитрата калия равна 30 г.
m(KNO3) = 110 г - 30 г = 80 г.
Ответ. 80 г. масса соли выпадает в осадок.
Приложения:
Похожие вопросы
Предмет: Математика,
автор: elenabezruk3
Предмет: Алгебра,
автор: Katyshka2021
Предмет: Математика,
автор: aleksandrsmorodov678
Предмет: Алгебра,
автор: footbol1
Предмет: Математика,
автор: crucowandrew